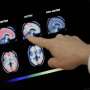
FDA批准由专家们批准的大量辩论的Alzheimer药物

周一的政府卫生官员在近20年内批准了阿尔茨海默病的第一个新药,忽视了独立顾问的警告,即众多争议的治疗尚未显示出慢慢减缓脑毁灭的疾病。
食品和药物管理局表示,它根据似乎“合理可能”为患有阿尔茨海默病患者的结果批准了生物原生物的药物。
这是美国的唯一治疗方法,即美国监管机构所说的可能会治疗潜在的疾病,而不是管理焦虑和失眠等症状。
可能影响数百万美国人及其家庭的决定肯定会引发医生,医学研究人员和患者群体之间的分歧。ob欧宝直播nba它对用于评估实验疗法的标准的标准也具有深远的影响,包括仅显示增量效益的标准。
与日本的Eisai Co.开发的生物因的新药物并没有反向精神衰退,只在一项研究中放缓。药物,Aducanumab,将被销售为Aduhelm,并且每四周将作为输液给予一次。
建议禁毒批准的FDA顾问Caleb Alexander博士表示,他的决定被“惊讶和失望”。
“FDA得到了它所做的尊重,因为它具有基于公司证据的监管标准。在这种情况下,我认为他们在约翰霍普金斯大学的医学研究员亚历山大说,他们给了产品。”ob欧宝直播nba
FDA的顶级药物监管机构承认“残余的不确定性”包围药物,但表示Aduhelm在大脑中减少斑块有害丛的能力有助于缓慢痴呆。
“数据支持患者和护理人员可以选择使用这种药物,”Patrizia Cavazzoni博士告诉记者。她说,FDA仔细称赞生活中的人们的需求,以“毁灭性,衰弱和致命的疾病”。
根据所谓的加速批准,FDA要求制药商进行后续研究以确认患者的益处。如果研究未能表现出有效性,FDA可以将药物从市场上拉动,尽管原子能机构很少这样做。
生物因表示,对于典型的一年的治疗,该药物将花费约56,000美元,并表示,这一价格不会筹集四年。由于保险范围和其他折扣,大多数患者不会在附近的任何地方支付。该公司表示,它旨在通过2030年完成该药物的后续试验。
非营利性临床和经济审查研究所表示,如果在后续研究中没有确认药物的益处,则“任何价格过高”。
美国的大约600万人和更多全球拥有阿尔茨海默,逐渐攻击内存所需的大脑,推理,通信和基本的日常任务所需的区域。在疾病的最后阶段,那些受到困境的人失去了吞咽的能力。全球疾病的负担,痴呆症最常见的原因,只预计将增长,因为数百万婴儿潮一代进一步进入60年代和70年代。
Aducanumab(发音为“添加的”Add-Yoo-Can-Yoo-mab“)有助于清除来自脑的蛋白质称为β-淀粉样蛋白。其他实验药物之前已经做到了,但它们对患者的思考能力没有差异,为自己或独立生活而思考。
除了阿尔茨海默氏症的治疗失败,制药业的药物管道已经乱扔垃圾。FDA的Greenlight星期一可能会恢复以前由药制造商搁置的疗法的投资。
新药由活细胞制造,并通过在医生办公室或医院注入。
研究人员并不完全理解Alzheimer但是,广泛的协议是由Aducanumab靶向的大脑斑块只是一个贡献者。证据表明家族史,教育和慢性病等糖尿病和心脏病等可能都发挥作用。
“这是希望但不是最终答案的迹象,”国家老龄化研究所主任理查德·霍比州博士说,该学院董事博士并没有参与生物学研究,而是对阿尔茨海默氏症的形式进行资金研究。“淀粉样蛋白是重要的,但不是唯一的贡献因素。”
服用的患者Aducanumab看到他们的思维技能比采取安慰剂的患者更慢地下降22%。
但这意味着对认知和功能能力的18分的分数仅为0.39。目前尚不清楚这些指标转化为实际福利,如更大的独立性或回忆重要细节的能力。
FDA对药物的审查已成为用于评估难以治疗条件疗法的标准的长期辩论中的闪点。在一方面,代表阿尔茨海默患者及其家庭的团体表示任何新的治疗 - 甚至是小额惠益保证批准。但许多专家警告说,绿色的药物可以设定一个危险的先例,打开门来治疗可疑益处。
尽管在FDA的神经学专家外面的FDA外面,虽然11月份的评估,但批准了。本集团对一系列问题投票给了生物原性提交的单一研究的重新分析数据是否有效。

生物原性在2019年停止了两项研究,后令人失望的结果建议,阿杜纳姆将无法达到阿尔茨海默患者心理和功能下降减缓的目标。
几个月后,公司逆转课程,宣布对其中一个研究的新分析表明该药物以较高剂量为有效,FDA建议其保证审查。科学家表示,该药物的初始失败是由于一些没有接受足够高的剂量来减缓疾病的患者。
但是,给药的变化和公司的事实分析使结果难以解释,在许多专家之间提高怀疑,包括FDA小组。
FDA不需要遵循其外部小组成员的建议,并在制作类似的高调药物决策时忽略了他们的意见。
大约600名美国医学专家已经通过生物原性的研究规定了药物,预计更多将开始提供它。许多实际问题仍未得到答复:患者受益多久?医生如何确定何时停止药物?药物是否对更先进的痴呆症患者有任何好处?
通过FDA批准,Aducanumab肯定是由几乎所有保险公司(包括Medicare)的保险公司涵盖的,所述医疗保险,占领6000多万人的老年人。
甚至符合药物的资格可能是昂贵的。它只在阿尔茨海默氏症或不太严重的痴呆症的人的人们中进行了测试,或者令人沮丧的严重认知障碍。为了验证诊断,可能需要大脑扫描,从而造成5,000或以上的费用。保险公司(包括Medicare),不涵盖扫描,因为他们的好处不明确,但如果扫描成为治疗的门户,可能会改变。
需要额外的扫描来监测潜在的副作用。该药有关于临时脑肿胀的警告,有时会导致头痛,混乱和头晕。其他副作用包括过敏反应,腹泻和迷失方向。
对于生物原性研究的患者来说,决定意味着他们可以继续吸毒许多人认为有帮助。
在遇到记忆力,阅读和驾驶困难之后,凯文·邦汉姆于2016年被诊断出患有早期的Alzheimer。来自宾夕法尼亚州贝尔溪村的63岁,聘请了这些药物,帮助他让他的工作作为地图制造者再持续三年。
“很快就像一个月的时间就像雾从头顶上抬起,”邦汉姆说,他现在的残疾并依赖于他的妻子金,帮助他照顾他和他的十几岁的女儿。
与其他试验参与者一样,Bonham必须在Biogen停止试验后,不得不在2019年3月停止服用Aducanumab。他将近一年前恢复输送,作为公司正在进行的研究的一部分。
©2021相关的压力机。版权所有。未经许可,可能不会发布,广播,重写或重新分配此材料。














用户评论