在肿瘤细胞中发现的新型结构可以为新种类的癌症疗法开门
2015年,加州大学旧金山分校的研究人员发现了生物学家以前从未见过的肿瘤细胞内部结构。更令人惊讶的是,对该结构的进一步检查发现它含有信号蛋白 ,即受体酪氨酸激酶,或rtk,这种蛋白被认为只存在于细胞表面。研究人员报告了这种新型结构的存在,但它们的确切身份和功能仍然难以捉摸。
现在,在论文中发表的论文中细胞,同样的UCSF研究团队正是如此构造,它们如何形成和其角色癌症。结果代表了一种新的机制,肿瘤可以用来促进其生长和生存,但他们也揭示了一个可能导致一类新的癌症毒品的脚跟。
“这是实验室所制定的更令人兴奋的发现之一,”学习的医学教授和博士学位,博士学位,博士学位说。“它开辟了一种全新的思考受体酪氨酸激酶如何进行致癌信号传导功能的新思考方式,可以提供一种解决癌症耐药性的新方法。”
突变的rtk会将健康细胞转化为癌症
在健康的细胞,rtks嵌入中脂质膜环绕大多数细胞室,最明显的是细胞表面。虽然RTK产生促进细胞分裂和生长的信号,但细胞通常能够通过开关这些信号蛋白来严格控制RTK的活性。但这一过程可能会失调并导致癌症。
由于尚未完全了解的原因,基因组有时会变得不稳定,导致编码rtk的基因经历一种基因混合和匹配。当这种情况发生时,RTK基因片段与其他基因片段融合,形成突变基因,编码所谓的“融合蛋白”。这些融合蛋白保留了RTK的片段,这些片段告诉细胞生长和分裂,但它们缺少关键部分,允许细胞关闭它们。因此,RTK融合蛋白可以触发不受约束的细胞生长,这是癌症的一个标志。
但关闭开关不是这些融合蛋白缺失的唯一事情。它们也缺少通常指示RTK的“分子GPS”,以将其插入脂质膜中。虽然科学家们长期以来,但是在形成rTK融合蛋白期间,这种膜靶向功能丢失,它们不明白这些突变蛋白在哪里或者如果它们不能在膜中嵌入它们的情况下。这项新的研究在这种长期的谜团上阐明了闪光。
融合蛋白组装成促进肿瘤生长的新型结构
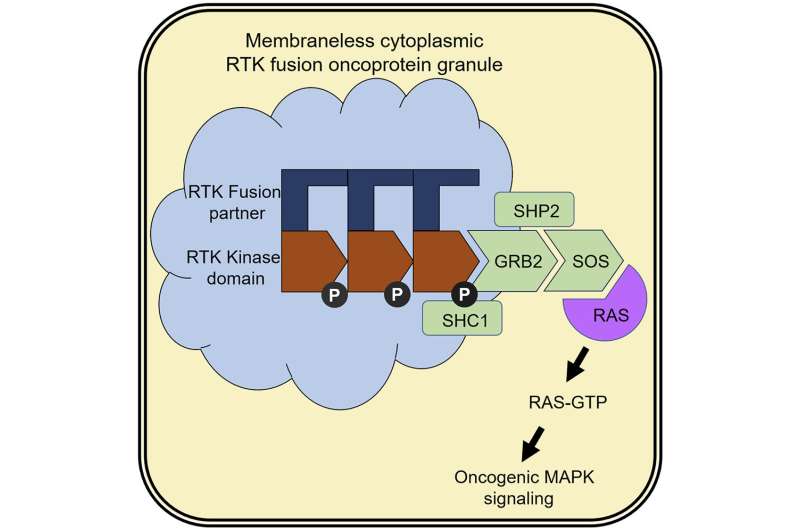
科学家们发现融合蛋白能够聚集在细胞的细胞质中,细胞质是一种凝胶状的液体细胞并形成新的结构,主要由突变的RTKs组成。与大多数被脂膜包围的细胞室相比,这些结构明显没有膜。
“他们基本上是坐在细胞质中的蛋白质组装,”比维纳说。虽然它们缺乏大多数蜂窝隔间的复杂性,但是结构是简单的,它们肯定不是良性的。
研究人员发现,这些结构可以招募和激活其他信号蛋白,这些蛋白负责将健康细胞转化为癌症。简而言之,当这些结构形成时,它们就成为了产生促癌信号的工厂,包括被称为RAS - GTPases的分子开关的激活,当这些被细胞质中的突变rtk“打开”时,就会促进癌症的发生。
“这是致癌激酶可以形成这些结构的第一次演示,以及RTK的第一次演示在没有脂质膜的位置处的位置激活并向RA发出信号,”Bivona说。
虽然研究人员能够证明这些结构是如何导致癌症的,但他们也发现了一个弱点,这可能为一种全新的癌症治疗方式带来希望。
结构的阿喀琉斯之踵可能会带来新的抗癌药物
虽然RTK融合蛋白长期以来一直是抗癌药物的靶标,但这些药物通常通过阻断融合蛋白中负责产生癌前信号的位置来发挥作用。虽然这些疗法一开始往往是有效的,但大多数癌症会发生突变,最终导致这些药物无效。然而,这项新的研究表明,一种防止融合蛋白结构形成的替代方法可能为rtk驱动型癌症患者提供新的希望。
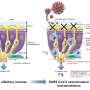
研究表明,RTK融合蛋白必须组装成更大的结构,以刺激肿瘤的生长和生存。研究人员发现,他们可以通过突变RTK的特定部分来阻止这些结构的形成融合蛋白质。他们还能识别出一些通常与RTK信号相关的蛋白质,当它们从细胞中移除时,也能阻止结构的形成。重要的是,科学家们发现了RTK融合蛋白不能产生促进癌症的信号,除非它们是更大的结构。
研究人员认为,这一要求代表了一个阿喀琉斯之踵,可能激发出一种新的靶向疗法,通过破坏这些结构的形成来发挥作用。但是根据Bivona的说法,还有很多工作要做,以了解是什么规则控制着这些结构的组装和降解,以及我们如何利用这些知识来开发新的疗法。












用户评论