转移促成因素:研究结果可能开启新的卵巢癌治疗方法

为了扩散它们的破坏,卵巢癌细胞必须从它们的肿瘤巢中挣脱出来,穿过腹膜腔中的液体,附着在腹部器官的外部——必然是不粘的表面。
尽管有这些挑战,大多数卵巢癌患者癌症在转移开始后才被诊断出来,导致患者预后不佳。卵巢癌研究基金联盟(ovarian cancer Research Fund Alliance)的数据显示,虽然卵巢癌在美国女性中只排在第11位,但它导致的死亡人数却排在第5位。
威斯康星大学麦迪逊分校(University of Wisconsin-Madison)生物医学工程教授帕梅拉·克里格(Pamela Kreeger)实验室的新研究已经确定了一种方法卵巢癌细胞似乎成功传播了。这项工作,今天在杂志上有详细介绍癌症研究这项研究可能会导致新的治疗方法来抑制这些肿瘤的转移。
“像大多数癌症一样,它不是原发性的肿瘤这通常是问题所在。肿瘤扩散到附近的器官会导致严重的并发症,”Kreeger说。“所以如果你能减缓这一过程,病人就有可能活得更长,或生活质量更好。”
在研究高级别浆液性卵巢癌(最常见但也是最具侵略性的类型)时,克雷格、博士后莫利·卡罗尔和其他实验室成员已经弄清了一种类型的免疫细胞帮助癌细胞附着在腹膜腔,使转移。更高水平的这些免疫细胞被称为交替激活的巨噬细胞,与更糟糕的结果相关。但问题仍然存在:这些巨噬细胞会促进转移吗?
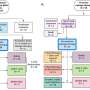
为了找到答案,Kreeger的团队创造了一种微型培养装置,使他们能够将关键的参与者聚集在一起:巨噬细胞、癌细胞和排列在腹膜腔中的间皮细胞。实验表明,巨噬细胞通过使间皮细胞更具粘性来增加肿瘤细胞对间皮细胞的附着。
“对我来说,这是一个科学的‘啊哈’时刻——我们体内正常细胞之间的相互作用可以影响转移。换句话说,这并不完全与肿瘤细胞有关,”Kreeger说。
但是,研究小组在共培养装置中检测到的25种蛋白质中,哪一种是造成这种效果的原因呢?计算模型揭示了罪魁祸首。巨噬细胞产生一种叫做MIP-1β的蛋白质,它会导致间皮的细胞产生更多的p -选择素粘附蛋白。反过来,p -选择素允许癌细胞粘附。
在小鼠身上进行的初步实验证实了这些结果,而通过威斯康星大学麦迪逊医学院和公共卫生学院的合作者获得的人类样本显示,卵巢癌患者的MIP-1β和p -选择素水平更高。
好消息是:已经有几种针对其他疾病开发的药物可能会被证明是有用的。用于治疗艾滋病毒的马拉维洛克(Maraviroc)可以抑制MIP-1β受体,而针对p -选择素的两种不同药物正在血液疾病的临床试验中。
“我们对寻求多种途径很感兴趣,因为其中一种可能比另一种更好,”Kreeger说,他的团队已经向威斯康星校友研究基金会申请了这项发现的临时专利。“也有可能一种药的副作用比另一种药更容易忍受。”
Kreeger将利用最近从Rivkin卵巢癌中心获得的拨款,在小鼠身上进行长期实验,进一步验证这一发现,为药物治疗的临床前测试奠定基础。
这篇论文的第一作者卡罗尔说,能够针对癌症扩散的另一个方面,而不仅仅是用化疗来对抗肿瘤生长,这为治疗开辟了新的途径。
“治疗卵巢癌在过去20年里,这一点真的没有改变。”“希望通过这种维持疗法的发展,我们可以防止新的肿瘤转移的形成。”
进一步探索