基因研究发现了治疗三阴性乳腺癌的联合疗法

乳腺癌是世界各地癌症死亡的主要原因,每天负责1,700人死亡。虽然绝大多数乳腺癌是可治疗的,但最具侵略性的亚型 - 三重阴性乳腺癌(TNBC) - 具有高复发率,转移的高潜力,并表现出对常规治疗的抗性,导致预后和存活结果非常差。麦吉尔大学卫生中心研究所(RI-MUHC)研究院的一支研究人员进行了临床前研究,发现了一种新型靶向联合治疗,可有效降低转移性乳腺癌的肿瘤生长。出版于自然通信,他们的发现可能会导致一种新的一线靶向治疗TNBC,并有可能迅速过渡到人类临床试验。
“TNBC没有针对性治疗。化疗治疗甚至可以丰富这些肿瘤癌症干细胞随着我们在先前的一项研究中所示,对患者有害,“Ri-Muhc和研究主要调查员癌症研究计划的高级科学家Jean-jacques lebrun博士说。”填补了巨大的医疗差距我们在进行这项研究方面是我们的动机。“
虽然大多数乳腺癌具有三种主要受体中的一种,类似于治疗的入口门 - 雌激素,孕激素和称为人表皮生长因子(HER2) - TNBC的蛋白质没有,因此名称三重阴性乳腺癌.使用最先进的技术,如基因编辑通过全基因组分子方法,该团队确定了两种治疗策略的靶向途径。
进行体内基因筛选:一种创新的方法
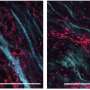
在研究的第一部分中,研究人员团队能够鉴定约150个基因,可以诱导肿瘤形成(癌症)或预防肿瘤形成(肿瘤抑制剂)。为了实现这一点,它们筛选了整个人类基因组 - 所有20,000个基因 - 在TNBC的临床前小鼠模型中。使用基因编辑技术CRISPR / CAS9,它们单独切割每种基因,并诱导它们失去的功能 - 一种称为基因敲除的过程。到目前为止,很少有研究在体内克里普尔特屏幕中使用了这些前向遗传筛查。
研究小组随后发现TNBC具有致癌作用途径(MTOR)被激活,而肿瘤抑制途径(HIPPO)被抑制,这可能解释了为什么这些肿瘤如此具有侵略性和致命性。
鉴定转移性乳腺癌的有效药物
为了建立其调查结果的治疗相关性,该团队进一步迈出了一步。
“通过破坏所有基因的功能,一个接一个,我们发现了参与肿瘤发展调控的两个主要途径,”mi - muhc Lebrun实验室的研究助理、该研究的第一作者Meiou Dai博士解释说。“我们想,如果我们拿一个现存的药品这可以阻断致癌途径并添加一种可促进肿瘤抑制途径的一种,我们可以在阻塞方面产生效果癌症形成。”
研究人员观察了现有的能够针对这些途径的药物,并进行了体内和体外实验。结果,他们发现了两种有效的药物:Torin1,一种已知阻断MTOR通路的第二代药物,和维泊芬,一种通常用于视网膜眼病的药物,可以模仿HIPPO通路。他们将这两种药物混合在一起,并使用数学模型和药理学方法来确定这两种药物是独立作用还是协同作用。
“我们的发现超出了我们的预期:两种药物以协同的方式作用,有效地减少肿瘤生长的体外和体内,使用细胞和患者来源的异种移植TNBC模型,”Dr. Lebrun说,他也是麦吉尔医学院的教授。
协同作用几乎完全根除了肿瘤
在研究中,研究人员注意到维泊芬诱导细胞死亡通过凋亡这一非常经典的细胞死亡机制。Torin1,另一方面,通过non-apoptotic诱导细胞死亡机制称为macropinocytosis,内吞作用的过程也被称为“细胞喝,”它允许所有细胞外的营养物质和水分被纳入细胞,最终导致细胞的内爆和灾难性的细胞死亡。
“巨胞吞作用是一种自然的致癌机制细胞用于他们自己的优势,越来越越来越快,“Dr. Dai博士解释道。”我们意识到,当我们一起使用这两种药物时,Torin1利用这种机制来利用将Verteporfin掺入细胞中,从而增加后凋亡细胞死亡效果。这是这种协同过程,允许两种药物有效地抑制肿瘤形成。“
影响/结果
这项综合研究的结果确定了一种新的方法,通过同时靶向促癌通路和抑癌通路,有效地防止肿瘤形成和减少肿瘤负担,即肿瘤的大小或肿瘤在体内的数量。提出有针对性的联合治疗对于TNBC患者,患者将有助于填补转移乳腺癌领域的重要医学间隙。
最后,这项研究强调了体内CRISPR全基因组筛选在识别癌症临床相关和创新治疗模式方面的力量和健壮性。
进一步探索











用户评论