渐冻症之谜的新线索,额颞叶痴呆

对流氓蛋白的特别关注可能会在阻止肌萎缩性侧索硬化症(ALS)或额颞叶痴呆患者神经细胞破坏的进展方面带来未来的希望。
渐冻症是一种罕见但毁灭性的疾病,也被称为卢伽雷氏病,它会攻击身体的神经系统神经细胞,随着时间的推移,神经元退化,导致渐进性肌肉无力。没有治愈方法。ALS患者最终会失去力量以及移动手臂、腿部和身体的能力。
大约三分之一的ALS患者还会患上额颞叶痴呆(FTD),这是一种大脑神经元的破坏,会导致严重的性格变化和残疾。这两种疾病在病理和遗传学上都有相似之处。FTD往往比阿尔茨海默病更早影响人们,阿尔茨海默病是最常见的痴呆症类型。
研究人员早就知道,对于大多数ALS和FTD患者来说,a蛋白质TDP-43在神经中聚集细胞.TDP-43的积累可能是ALS和FTD中神经细胞死亡的原因。确切地了解这种情况是如何发生的,以及为什么会发生,是密歇根医学院神经病学助理教授萨米·巴马达(Sami Barmada)医学博士和他的研究团队的重点。
他们最新的临床前研究结果发表在细胞的报道,精确定位结构这对TDP-43蛋白的功能及其导致神经细胞死亡的能力至关重要。在这个过程中,他们发现了阻止神经细胞破坏的潜在线索。
“通过操纵蛋白质的结构,”Barmada说,“我们确定RNA结合是维持疾病模型中TDP-43的稳定性、功能和毒性的关键。”
迷失在翻译中
RNA的主要功能是将DNA的分子指令翻译成蛋白质。要将RNA翻译成蛋白质,它必须经过正确的加工,并且它必须持续足够长的时间来进行翻译。通常情况下,TDP-43有助于调节RNA的加工和稳定性。
Barmada的团队证明,当TDP-43过多时,RNA就会不稳定。受影响最大的rna涉及能量和蛋白质的产生,这是神经细胞生存所需的两条途径。他们在渐冻症患者的细胞中发现了相同的模式,这表明TDP-43可能是罪魁祸首。
那么,TDP-43的积聚是如何导致神经细胞死亡的呢?Barmada和他的同事怀疑这与TDP-43结合RNA的能力有关,他们专注于操纵蛋白质的这一功能。
由于蛋白质结构对功能至关重要,他们想知道是否可以通过改变TDP-43的结构来改变其功能。通过引入特定的突变,他们中断了RNA结合所需蛋白质的两个部分之间的相互作用,创造出无法结合RNA的TDP-43版本。出乎意料的是,他们发现当TDP-43不能结合RNA时,它会迅速降解,这使他们相信这些版本的TDP-43对神经细胞不会那么致命。
观察神经元退化
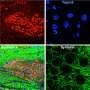
为了确定这些工程版本的TDP-43是否对神经细胞有毒,Barmada的团队使用了一种称为自动显微镜的方法。在这里,数千个培养中的神经细胞随着时间的推移使用完全由程序控制的显微镜成像。附加程序分析数据,确定每个细胞死亡的时间,并使用方法比较不同的条件人体临床试验.
Barmada说:“这就像在一个培养皿中进行临床试验,测量每个神经细胞的命运,就像测量一个人一样。”“我们看到,当我们中断结构时,它极大地破坏了蛋白质的稳定。细胞只是把它嚼碎了。
他说:“我们知道,在疾病中,如果TDP-43过多,细胞就会死亡。”“如果过量的TDP-43被降解,就像这里一样,细胞就被拯救了。”
为了进一步支持他们的结论,研究人员与密歇根大学药学系的Asim Beg博士合作,使用CRISPR/Cas9基因组工程创建了具有相同结构变化的TDP-43蠕虫模型。表达这些版本TDP-43的蠕虫与根本没有TDP-43的蠕虫完全相同,这表明突变所针对的结构对TDP-43的功能和毒性至关重要。
针对结构
综上所述,研究结果表明,在ALS和FTD模型中,修改TDP-43结构消除了其结合RNA的能力并导致神经细胞死亡。
针对这一结构开辟了探索ALS和FTD新疗法的潜力。
“如果你有一种方法可以打断这种结构,你可能会清除那里多余的TDP-43,并预防神经细胞死亡,”Barmada说。
这种方法可能采用药物的形式,与TDP-43相互作用,干扰其结构并导致TDP-43降解。即便如此,完全去除TDP-43是不可行的,因为这种蛋白质是生命所必需的。“但从理论上讲,剂量是可以调节的,这可以让你在TDP-43上拨号,”巴马达说。这就引出了下一个问题:“魔法水平是多少?”
更多信息:Brittany N. Flores等人,TDP43 RNA结合、蛋白质稳定性和TDP43依赖性神经退行性变的分子内盐桥,细胞的报道(2019)。DOI: 10.1016 / j.celrep.2019.03.093