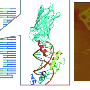
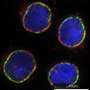
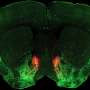
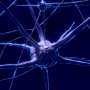
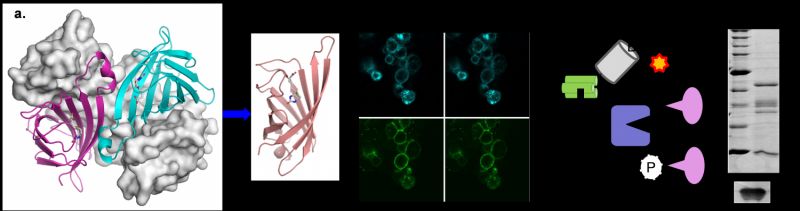
工程单体的链霉亲和素的细胞标记和间接依赖生物素酰化
布法罗大学的一组研究人员在阿默斯特,纽约已经成功地设计了一个新颖的变体链霉亲和素形成一个稳定的单体和单价生物素检测的能力。链霉亲和素是广泛用于检测生物素化的配体,但可能会导致目标交联,可以在分子水平干扰观测。工程链霉亲和素单体(mSA)结合生物素化的目标没有交联,因为它只有一个生物素结合位点。基因结构单体,mSA也可以融合到另一个蛋白质形成生物素标记有约束力。绑定的生物素化的配体融合mSA域是有用的在各种生物化学和细胞生物学的研究。mSA的优化设计及其潜在的应用在标签和蛋白质相互作用的研究描述了在即将到来的2016年出版的杂志技术。
“本地streptavidin-biotin交互的局限性源于链霉亲和素的专四聚物的结构。小,单一域蛋白质结合生物素,如mSA,延伸的效用streptavidin-biotin系统通过允许单价生物素检测和基因融合,”谢尔登公园教授说,博士,布法罗大学的首席研究员在纸上。
链霉亲和素及其同系物所有形成低聚物,很难将其作为基因融合。集团此前公布的工程稳定的单体的蛋白质结合生物素纳米亲和力较低,表明分子可以融合GFP创建bi-functional分子。在这项研究中,一组优化设计和演示了如何设计分子可用于生物技术。显著改善mSA的绑定特性包括稳定的生物素结合复杂的生物素化的目标达到一致的标签。例如,使用mSA共轭荧光团,生物素化的细胞表面受体可以稳定,特别是,标记在一段与小信号损失1小时,在荧光显微镜研究应该有用。
与低聚物的链霉亲和素,mSA很容易融合到一个感兴趣的蛋白质(POI)构建重组标记生物素绑定。目前的研究探讨了使用mSA融合邻近de-pendent biotinylation-a技术在蛋白质组学研究已被证明是有用的。距离依赖生物素酰化利用酶或化学方法有选择地biotinylate POI相互作用的分子,这样他们可以使用固定化亲和纯化链霉亲和素。作者证明了mSA标签可以用来招募活性生物素的物种,实现特定生物素酰化的直接或间接相互作用的分子。因为只有co-localization mSA需要这工作,不需要mSA的直接融合。相反,mSA可能招募POI通过一系列的共价相互作用,例如,用一个抗体,以生物素酰化的目标相互作用的分子。设计提供高水平的模块化和作用于分子相互作用仅是暂时性的,如酶及其底物。
乌兰巴托的团队正致力于进一步减少生物素分解的速率,以优化标签更效率。为此,mSA的晶体结构(PDB 4 johnson & johnson)用于模型的影响各种突变之前在实验室里测试。mSA的改进的生化特性及其小得多的规模(这样25%的链霉亲和素)在生物技术通过利用现有的基础设施和创造新的机会无处不在的streptavidin-biotin系统研究新的交互。