研究人员对1型糖尿病的内分泌胰腺进行了生物工程改造
1型糖尿病患者体内的免疫系统会攻击并破坏产生胰岛素的β细胞。β细胞控制血糖水平,是胰腺中一组被称为胰岛的细胞的一部分。在发表于细胞报告医学最近,麻省总医院(Massachusetts General Hospital, MGH)的研究人员领导的团队开发了一种移植胰岛的有效方法,并证明该方法可以有效逆转非人类灵长类动物的1型糖尿病。MGH是麻省总医院布里格姆分校的创始成员之一。
胰腺胰岛移植是一种很有前途的1型糖尿病治疗方法;然而,目前的方法,包括将胰岛移植到肝脏,是低效的,可能导致多达一半的移植β的损失细胞因为免疫攻击而且,肝脏只能容纳有限体积的移植组织。
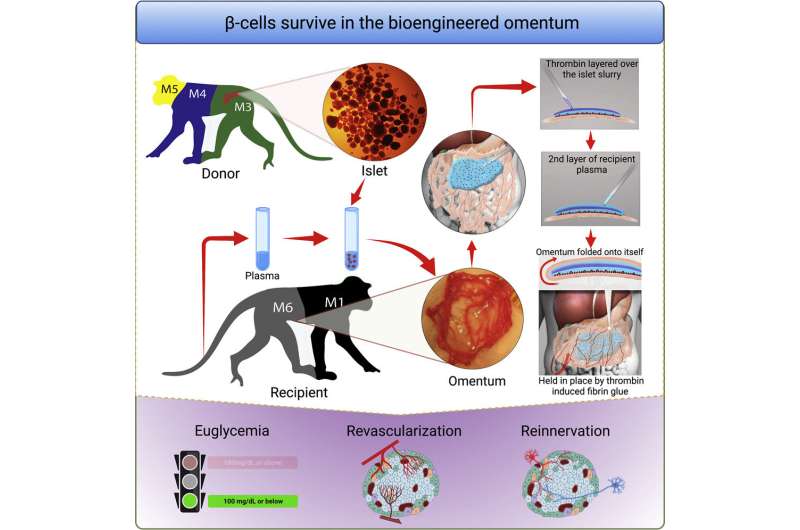
科学家们想知道,另一个地点是否可以提供一个更适宜的环境,并导致更好的结果。一个有希望的部位是网膜,这是一种始于胃、覆盖于肠道的脂肪组织。
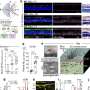
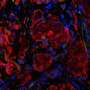
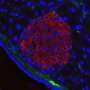
为了优化大网膜作为个体移植部位,研究人员使用局部重组凝血酶(止血)、一种酶和接受者自己的血浆来设计一种生物可降解基质,供体胰岛被固定在大网膜上。当这种策略与免疫抑制疗法一起使用以保护胰岛免受免疫攻击时,这种方法正常化了血糖水平并恢复了三个人的葡萄糖反应性胰岛素分泌非人灵长类动物患有1型糖尿病的人
“完全血糖控制的成就归功于生物工程方法,它促进了移植胰岛的血运重建和神经再生过程,”第一作者、MGH移植外科研究员、医学博士、理学硕士邓洪平(Hong Ping Deng)说。“这是第一次在非人灵长类动物模型上进行这样的演示。”
“这项临床前研究可以为糖尿病β细胞替代的新策略的发展提供信息,并可能改变目前临床胰岛移植的范式,”高级通讯作者Ji Lei说,他是MGH移植外科的首席医生研究员,哈佛医学院外科助理教授。“我们正计划进行临床试验来测试这种方法。”
雷也是MGH人类胰岛/细胞加工特殊服务cGMP设施的主任,他指出,除了移植来自捐赠者的胰岛,研究人员还在研究移植干细胞衍生胰岛的潜在广泛应用,在2022年人类历史上首次治愈了1型糖尿病患者,并可能提供无尽的可移植组织供应。然而,人们对这种方法存在担忧,包括肿瘤发展的可能性。
与肝脏不同的是,大网膜很容易被用于监测目的,其非重要部位的状态可以允许在发生并发症时移除移植组织,无论是来自干细胞的胰岛还是来自捐赠者的胰岛。此外,工程大网膜部位可以是许多其他类型的基因工程细胞的家园,特别是肝脏或遗传性代谢或内分泌疾病。
共同作者James F. Markmann医学博士,MGH移植外科主任和移植中心临床操作主任,强调非人灵长类动物研究是一种高度转化的临床前动物模型。他说:“这种策略的应用,特别是在基于干细胞的治疗中,有可能彻底改变治疗1型糖尿病患者的范式。”
更多信息:邓宏平等,生物工程大网膜移植位点促进异体胰岛移植在非人灵长类动物中的存活,细胞报告医学(2023)。DOI: 10.1016 / j.xcrm.2023.100959