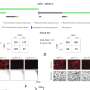
通过诱导神经炎症促进乳腺癌和黑色素瘤脑转移的机制
特拉维夫大学的一项新研究发表在该杂志上自然癌症,萨克勒医学院病理学系肿瘤生物学实验室主任Neta Erez教授领导的研究团队确定并描述了一种促进脑转移形成的新机制,并发现削弱这一机制可显著减少小鼠脑转移的发展。
脑转移是最致命的癌症转移形式之一。它们比中枢神经系统肿瘤(CNS)常见2-10倍。尽管近年来在黑素瘤和乳腺癌在美国,脑转移仍然是高度致命的,许多病例的严重生存率不到一年。
有记录的发病率脑转移近年来一直在增加,可能是由于诊断方法的改进以及其他器官转移治疗的进展。因此,研究更好的脑转移的治疗策略是当务之急。
在特拉维夫大学的这项新研究中,研究人员表明脂脂素-2 (LCN2)是诱导大脑神经炎症的关键因素。此外,研究人员还发现,患者血液中LCN2的高水平和几种癌症的脑转移有关疾病进展降低了存活率。
LCN2是一种分泌蛋白,在先天免疫系统中起作用,最初被发现是因为它能够结合铁分子,并且是对抗细菌感染的炎症过程的一部分。LCN2由多种细胞产生,并被证明参与多种癌症相关过程。
Neta Erez教授说:“我们的研究结果揭示了一种以前未知的机制,由LCN2介导,它揭示了大脑招募的免疫细胞(粒细胞)和脑胶质细胞(星形胶质细胞)之间相互作用的核心作用,促进炎症和脑转移的形成。这一发现确立了LCN2作为一种新的预后标志物和潜在的治疗靶点。”
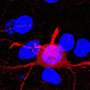
在这项研究中,研究人员使用了黑色素瘤和乳腺癌脑转移的模型,试图揭示神经炎症在大脑转移位点被激活的机制。
Erez教授说:“我们发现,从原发肿瘤分泌到血液中的信号刺激了大脑中星形胶质细胞的促炎激活。星形胶质细胞促进炎性细胞从骨髓(粒细胞)进入大脑,它们反过来成为LCN2信号的主要来源。
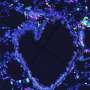
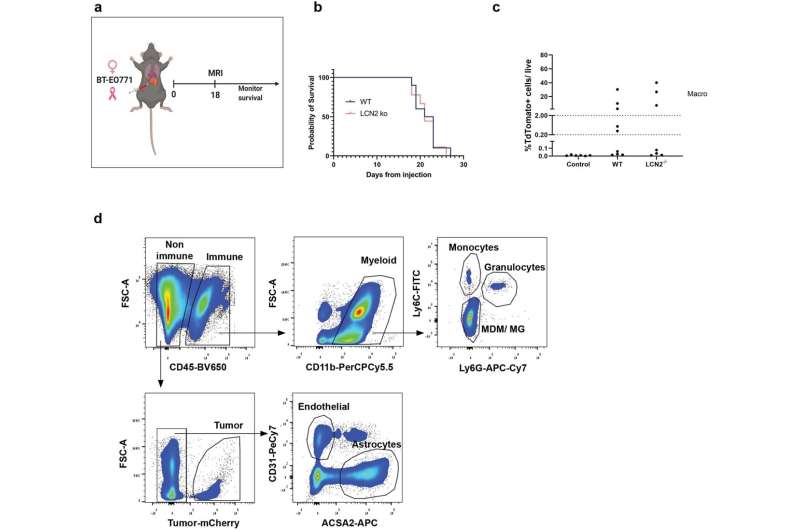
“我们通过基因抑制LCN2在小鼠中的表达,证明了LCN2对转移发展的重要性,这导致了神经炎症的显著减少和脑转移的减少。此外,在三种类型癌症脑转移患者的血液和组织样本中,血液LCN2水平与疾病进展和较短的生存期相关,这将LCN2定位为脑转移的潜在预后标志物。
“我们分析了脑转移小鼠的血液和脑脊液(CSF)中的LCN2蛋白水平,发现与健康小鼠相比,黑色素瘤和乳腺癌转移小鼠的LCN2水平大幅增加。重要的是,血液中LCN2的升高先于MRI检测到脑转移。此外,LCN2水平非常高的小鼠后来发生了脑转移,进一步确立了LCN2作为脑转移的预测标记物。”
研究人员还检查了初次诊断时黑色素瘤患者血液中LCN2是否升高,以及它是否可以成为预后因素。研究结果表明,与健康个体的样本相比,黑色素瘤患者血液中的LCN2水平明显更高。引人注目的是,发生脑转移的患者在诊断转移之前显示出明显较高的LCN2水平,血液中LCN2的高水平与较差的生存率相关。
Erez教授说:“我们已经确定了一种新的机制,其中LCN2介导了细胞间的交流免疫细胞来自骨髓和大脑中的支持细胞,激活炎症机制,从而有助于大脑转移性疾病的进展,并证明了其重要性。LCN2的功能和预后方面,我们已经在小鼠模型和癌症患者的脑转移中确定,这表明靶向LCN2可能是延迟或预防复发的有效治疗策略大脑转移。”
更多信息:Omer Adler等人,先天性免疫细胞和星形胶质细胞之间的相互作用通过脂脂素-2促进神经炎症和脑转移,自然癌症(2023)。DOI: 10.1038 / s43018 - 023 - 00519 - w