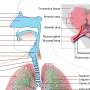
肠癌干细胞如何逃避抗血管生成治疗
路德维希洛桑的Tatiana Petrova, Jeremiah Bernier-Latmani和alum Christoph Cisarovsky领导的团队发现了一种新的机制,通过这种机制,肠道肿瘤中的干细胞产生新的血管,并逃避抗血管生成治疗。血管内皮生长因子A (VEGFA)是健康和恶性血管生成的重要支持者。但是抗vegfa疗法在治疗包括结直肠癌(CRC)在内的许多癌症方面取得了不同的成功。
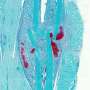
在抵抗抗vegf - a治疗的CRC肿瘤中,肠道干细胞与那些对治疗敏感的细胞相比,上皮祖细胞倾向于通过WNT途径发出强烈的信号。佩特洛娃和她的团队在小鼠模型中探索了正常和癌变的WNThigh细胞是如何维持血管支持的。他们在五月的一篇论文中报道自然心血管研究这两种类型的祖细胞都位于富含氧气的肠壁龛中,并被不依赖vegfa的血管包围。
癌性上皮祖细胞的增殖诱导了一种名为apelin的小蛋白质的产生,它触发内皮细胞从远处的静脉迁移到祖细胞生态位,在那里它们填充现有的血管。这支持了上皮祖细胞和独立于VEGFA的血管网络的协调生长。apelin的缺失抑制祖细胞增殖、生态位氧合和肿瘤生长,这为治疗抵抗VEGFA阻断的CRC肿瘤提供了一种新方法。