新的单细胞分析工具将免疫细胞与肾癌复发联系起来
与其他癌症相比,肾癌的免疫性脱颖而出:更多的免疫细胞渗透比大多数其他实体瘤的肾癌,肾癌是对当今免疫治疗方案最敏感的恶性肿瘤之一。
但尽管治疗,许多患者患有透明细胞肾癌 - 最常见的类型肾癌- 预期复发和产生可治愈的转移性疾病。
一项新的研究表明,肾脏肿瘤中存在一种罕见的、以前未知的免疫细胞类型,可以预测哪些患者可能患有这种肿瘤癌症手术后复发。这些细胞甚至可能引发恶性疾病
“我们的研究结果表明,这些细胞的存在可以用来识别手术后疾病复发的高风险患者,这些患者可能是更积极的治疗的候选人,”共同资深作者查尔斯·德雷克博士说。哥伦比亚大学瓦格洛斯外科医学院和赫伯特·欧文综合癌症中心的副教授。
该研究于5月20日在线发表在该杂志上细胞。Andrea Califano博士是哥伦比亚大学瓦格洛斯内科和外科医学院的化学和系统生物学的Clyde和Helen Wu教授和系统生物学主席,也是这项研究的高级合著者。
采用新工具,删除了配置文件单元格
尽管肾脏肿瘤被免疫细胞浓密渗透,但细胞亚型及其与手术后结果的关联仍然很大程度上。
这就像往下看曼哈顿,看到每天早上都会在曼哈顿看到大量的人,也就是说,MD / PH.D。哥伦比亚大学的学生Vagelos医师和外科医生和研究的联合第一作者。“要了解这些不同的通勤人员如何与曼哈顿居民互动,我们需要更好的细节:他们是谁;他们是什么样的,他们在哪里,他们在做什么?”
为了揭示渗透到肾癌中的免疫细胞的细节,研究人员结合了癌症研究中的两种最新技术。
第一种被称为单细胞RNA测序,它能捕捉到细胞内单个细胞基因活动的快照肿瘤。这种高吞吐量技术允许研究人员在单一实验中从一个肿瘤中获得数万个细胞内的此类快照,从而为各种细胞类型的身份和行为提供见解。
这种强大的技术可以识别新的细胞类型,但有一个缺点。因为单细胞测序是通过检测每个细胞内的少量mRNA分子来工作的,所以它常常不能检测到基因低表达水平,包括关键信号基因和药物靶点,如免疫治疗检查点。
“在许多实验中,单细胞RNA测序偏出高达90%的基因活性,这是一种称为基因辍学的现象,”Obradovic说。
预测算法解决基因丢失问题
研究人员开发了一种预测算法,通过观察其他相关基因的表达来推断哪些基因是活跃的,从而解决了基因退出的问题。奥布拉维奇说:“即使由于中途退出导致大量数据丢失,我们仍然有足够的线索推断上游调控基因的活动。”“这就像玩‘幸运之轮’一样:即使大多数字母都不见了,我通常也能猜出棋盘上是什么。”
该算法称为Meta-Viper,在加利福尼亚实验室开发的Viper算法上构建。Califano也是JP Sulzberger Columbia Genome中心的主任,赫尔伯特欧文综合癌症中心。
随着元避达的添加,研究人员估计它们可以准确地检测每种细胞中所有调节基因的70%至80%的活性,消除细胞上的丢失。
患者结果跟踪新鉴定的巨噬细胞
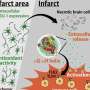
这种组合方法用于分析来自11名患者在哥伦比亚泌尿科泌尿外科患者的11例患者中患者的邻近组织中患有200,000多个肿瘤细胞和正常细胞。
分析显示了一个独特的亚群免疫细胞巨噬细胞仅在肿瘤中发现,并与初始治疗后疾病的最终复发有关。VIPER分析还揭示了控制这些巨噬细胞活性的顶级基因(或主调控基因)。该“签名”在与范德比尔特大学(Vanderbilt University)研究人员合作获得的第二组患者数据中得到了验证;在第二组超过150名患者中,该签名强有力地预测了复发。
此外,发现这些巨噬细胞通过受体 - 配体基因对直接与肿瘤细胞相互作用。“这些数据提高了这些巨噬细胞不仅仅是危险疾病的标志物的有趣可能性,而且可能实际上导致疾病进行复发和进展,”Obradovic说,“并且靶向这些细胞可以改善临床结果。”
因此,基于viper的技术,如Oncotreat测试,可以用来识别针对这些罕见但关键的亚群体的药物,从而防止与它们存在相关的不良结果,Califano说。
技术可以应用于其他癌症和疾病
研究人员说,单细胞测序和VIPER算法的结合也有潜力分析其他类型的癌症。
“我们的研究表明,当组合时,两种技术在表征肿瘤内和周围组织内的细胞,并且应该具有广泛的适用性,即使超出癌症的研究,”Drake说。
该研究标题为“单细胞蛋白活性分析识别复发相关的肾肿瘤巨噬细胞”。
进一步探索












用户评论