癌症免疫疗法方法是常见的遗传改变
研究人员为新的癌症免疫疗法开发了一种原型,该原型使用工程化T细胞来靶向所有癌症中常见的遗传改变。通过Ludwig Center,Lustgarten实验室和Bloomberg〜Kimmel研究员在Johns Hopkins Kimmel癌症免疫疗法的研究人员开发了缺少一个基因拷贝的细胞免疫应答的方法癌症中心。
基因有两种等位基因或副本,从每个父母继承一个副本。癌症相关的遗传改变通常涉及丧失这些基因拷贝之一。
“这种副本损失或LOH是最常见的遗传活动之一癌症,“Ludwig Center的联合主任,肿瘤科学教授,肿瘤学教授,博士金茨勒说,”博士·金茨勒说。
小说癌症免疫疗法方法将该缺失的基因复制转化为免疫细胞激活信号。“历史上,这些缺失的基因副本虽然癌症的标志,但由于蛋白质缺失,仍然是可行的治疗目标,因为蛋白质缺失。没有任何毒品,”Kinzler解释说。然而,免疫疗法以及工程师杀死T的能力细胞嵌合抗原受体(CARs)激活和抑制性嵌合抗原受体(iCARs)失活或关闭,使T细胞靶向LOH成为可能,他说。
这些调查结果是3月15日国家科学院的诉讼程序。
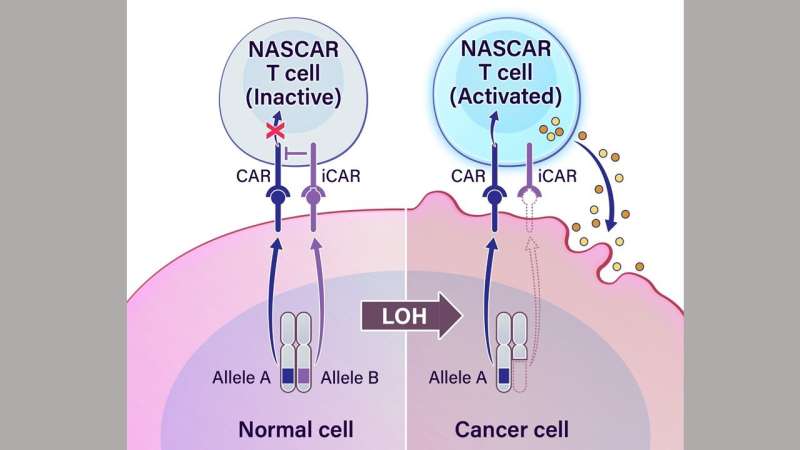
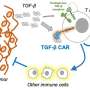
汽车是工程受体,其与癌细胞表面上的特定抗原结合。抗原是标志着癌细胞进行破坏的红色旗帜。在这种方法中,汽车与LOH结合并杀死细胞。研究人员称为NASCAR,用于肿瘤靶向等位基因传感车。
NASCAR T细胞被设计成表达一种激活分子(CAR)和一种抑制分子(iCAR)。该方法依赖于一个“不”门来开启或关闭T细胞。非门是一个计算术语,用来描述对输入信号进行否定。对于这种免疫治疗方法,它指示工程T细胞在遇到正常细胞或癌细胞时是否采取行动。如果两个基因拷贝都是现在的——a和b——抑制分子被激活,而工程T细胞对正常细胞没有任何作用。如果一个人基因副本存在,另一个是缺失-A,而不是B-工程化T细胞被激活并杀死癌细胞。
“在存在两位等位基因并表达的正常细胞中,NASCAR T细胞同时接受互联网的互联网 - 互相取消,”迈克尔·王,博士博士解释道约翰霍普金斯大学医学院和第一作者。“然而,在癌症中,一个等位基因丢失,因此没有抑制或脱信号。”研究人员创造了人造受体 - 汽车和icar - 能够区分从两种等位基因中的任何一种表达的蛋白质。
“癌细胞必须表达等位基因A,而不是等位基因B以激活NASCAR T Cell,”Brian Mog,M.D./Ph.D解释。候选人在约翰霍普金斯大学医学院和联册作者。
研究人员成功地在三种独立的细胞系中测试了它们的NASCAR疗法,以及小鼠模型。这包括有没有LOH的模型,以确认这种方法的特殊性基因改变。他们的实验室研究在美国,研究人员使用了HLA基因,但他们计划将这种方法推广到其他领域基因经历LOH。正在进行的研究还将专注于这些工程化T细胞的改进版本,具有更精确的汽车和icars。
“本研究提供了原则上,这种方法可用于选择性地杀死癌细胞,”肿瘤学和研究联合领导者的副教授博士周,博士说,这增加了几年在临床上进行测试。“它是一个漫长而复杂的过程,可以组装并完全测试所有组件。”
The new discovery builds upon more than three decades of research by Kinzler and Ludwig Center co-director Bert Vogelstein, M.D., who first identified the genetic alterations that contribute to cancer development and growth and are now developing new ways to use these alterations as therapeutic targets.
“近年来,显然,免疫系统是针对癌症的强大工具,”Kinzler说。他说,他们现在的焦点是开发新的免疫治疗,可以针对遗传改变,以将癌细胞与正常细胞区分开,目标是将免疫疗法的益处扩展到更多患者。
进一步探索













用户评论