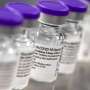
研究人员是如何如此迅速地开发出COVID-19疫苗的?

疫苗研发通常以年为单位,而不是以月为单位。但随着COVID-19大流行的肆虐,科学家们正在争分夺秒,打破记录,开发一种免疫系统,提供对病毒的保护。
这个国家的科学界还面临着另一个障碍:让公众相信COVID-19疫苗是安全的,以及首先接种COVID-19疫苗是多么重要。
“如果人们害怕或不愿接种,即使是最有效的疫苗也无法保护我们或我们的亲人,”传染病主任凯瑟琳·穆兰(Kathleen Mullane)说临床试验芝加哥大学医学院“我们知道事情进展得比以往任何时候都快,但国家科学界以前所未有的方式进行了合作和合作,我们绝对致力于确保最终批准的任何东西都是有效和安全的。我将接种疫苗,并建议我的家人和朋友接种疫苗,因为我相信这些疫苗的安全性和有效性。”
COVID-19疫苗的快速进展意味着,在疫苗被批准用于紧急用途后很长一段时间内,有关这些疫苗的长期安全性和持久性的数据仍将源源不断地流入。然而,那些想知道疫苗安全令人鼓舞的是,尽管这些疫苗的开发速度很快,但它们遵循了旨在保护患者的重要监管和评估检查点。这些里程碑有助于确定疫苗的安全性和有效性,以及其益处是否值得承担任何潜在风险。
曲速操作
在COVID-19大流行之前,新疫苗从概念到批准可能需要10年时间和数十亿美元。由于只有十分之一的候选疫苗能进入市场,疫苗开发对制药商来说是一项冒险的任务。
对于那些不熟悉临床研究的系统过程的人来说,这个过程可能会让人感觉非常缓慢。首先,研究人员必须研究病原体的结构和感染行为。然后他们想出了如何让人体产生最好的免疫反应来对抗它。接下来,对疫苗的安全性和有效性进行测试——首先使用细胞、动物和数学模型,然后在人体中进行人体临床试验涉及数千名参与者。只有到那时,联邦批准程序才能开始。
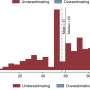
全球制药公司正在开发数十种针对SARS-CoV-2病毒的疫苗,但到目前为止,只有少数疫苗达到了大规模的三期临床试验。在第三阶段试验中,数万名志愿者参与测试免疫的安全性和有效性。到目前为止,全球已经启动了11个三期临床试验,但随着其他研究工作的推进,预计未来几个月和几年将有更多临床试验启动。
他们从制药业和联邦政府合作的“曲速行动”(Operation Warp Speed)中得到了提升。为了抵消COVID-19疫苗开发的成本,并帮助尽快向美国公众动员已获批准的疫苗,政府建立了近100亿美元的联邦基金。这大大加快了通过临床试验、FDA审查和疫苗大规模分发开发疫苗的时间表。
所有这些因素反过来意味着,一旦疫苗通过了关键的安全性和有效性里程碑,并获得了联邦政府的紧急使用批准,医疗保健机构就能够在几天内开始向患者提供疫苗。例如,辉瑞/BioNTech mRNA疫苗于2020年12月10日被FDA批准紧急使用;医护人员在12月14日之前接种了疫苗。
疫苗的工作原理
也应该令人欣慰的是,近200年的疫苗发展已经产生了许多高效和安全的疫苗平台,生产新型疫苗所需的时间和精力更少。重复利用现有的疫苗技术使研究人员能够集中精力找出最好的靶点,以产生最强的免疫反应和最小的副作用。
“实际上,大部分疫苗平台开发工作已经完成,”芝加哥医学大学人口与精准健康研究所所长Habibul Ahsan说。“你只需要做剩下的部分,即向已经被证明的平台添加正确的病毒抗原,并确保它对人类安全有效。即使在过去的5到10年里,我们在开发新型疫苗平台方面也取得了巨大的飞跃,比如正在测试SARS-CoV-2的疫苗平台。”
疫苗的工作原理是向人体免疫系统提供来自病毒的某些蛋白质,称为抗原,激活免疫反应,产生对抗疾病的抗体。
目前头条新闻的候选疫苗使用的是信使rna和基于载体的平台。基于媒介的疫苗过去已经被开发出来,用于治疗SARS、中东呼吸综合征,以及最引人注目的致命埃博拉病毒;mRNA疫苗此前已被测试用于预防寨卡病毒。
这些下一代免疫接种以前从未进行过如此大规模的试验,但已经有证据表明,这些平台是安全有效的,降低了以前类型的疫苗(如减毒活疫苗或灭活全病毒疫苗)产生副作用的风险。
“信使rna和载体疫苗是一项更新的技术;第一批产品是在1999年开发出来的。”“根据我们对人类生物学的了解,没有理由认为它们会比任何传统类型的疫苗带来更大的风险。如果有的话,最大的问题是它们的有效时间有多长。到目前为止,初步疗效数据非常有希望。”
结合临床阶段
为了加速研发,许多COVID-19疫苗试验是在结合第1、2和/或3阶段的研究中进行的,研究人员首先为少量健康志愿者接种疫苗。随着试验的继续,如果疫苗看起来是安全的,它就会向更多的参与者开放,比如那些已经存在健康问题的人。大规模的三期疗效试验最终将包括数万名志愿者。目前的试验阵容包括各种类型的疫苗——既包括可靠的模型,也包括下一代方法。
在任何疫苗获得联邦政府批准之前,即使是紧急使用,研究人员也必须等到数万名志愿者接受他们的实验疫苗。然后他们等待足够的时间,让其中一些志愿者接触到COVID-19,这表明每种疫苗的有效性。科学家们还在研究接种疫苗的人(与服用安慰剂的人相比)的病情是否更轻。如果没有确切的数据表明疫苗既安全又有效,它们就不会被批准用于公众。
一旦临床试验收集到足够的数据,表明疫苗既安全又有效,制药公司就会将数据提交给FDA,由联邦统计学家和科学和科学的外部顾问委员会对其进行审查和重新分析医学专家.由于大多数COVID-19疫苗将在获取任何长期数据之前提交给FDA,因此疫苗很可能会获得紧急使用授权,而不是完全批准。辉瑞/BioNTech mRNA疫苗的情况就是如此,该疫苗于2020年12月10日被FDA批准紧急使用,而Moderna mRNA疫苗则是在8天后。
这些试验的进展速度引发了人们对它们是否安全的质疑。科学家们意识到,由于大流行的政治化和某些社区历史性的医疗权利被剥夺,人们仍然存在不信任;因此,他们小心翼翼地不夸大正在进行的临床试验的早期结果,并对所涉及的风险保持透明。
许多人正在努力走进社区,与潜在的志愿者交谈,解决他们的担忧,并提供参与的机会,特别是大规模的第三阶段试验。例如,在芝加哥大学医学院,临床医生带着流动医疗队进入周围的社区,把疫苗直接送到人们的家门口。
Ahsan说:“少数族裔和低收入人群很难进入许多招募这些试验的中心。”“但芝加哥大学医学院一直在努力与当地社区建立牢固的关系,确保他们知道我们在这里为他们服务。”
疫苗会带来哪些风险?
像大多数医学治疗一样,任何疫苗都有一定程度的风险。副作用通常很轻微,从注射部位的疼痛到轻微的发烧和身体疼痛。在十万分之一的病例中,疫苗会引发严重的过敏反应。更罕见的(估计是百万分之一)是发展影响神经系统的自身免疫疾病的风险增加,如格林-巴利综合征。
两项独立的研究涉及活的非复制载体病毒疫苗。美国的阿斯利康三期疫苗试验和美国的杨森三期疫苗试验在一名参与者经历了一种被称为“不良反应”的无法解释的医疗事件后被短暂暂停,这种事件可能与他们参与研究有关。在研究人员和监管机构确定疫苗和医疗事件之间没有明确的联系,并认为它们足够安全,可以继续之后,这两项调查都恢复了。除了少数需要使用EpiPens的过敏反应外,尚未发现与mRNA候选疫苗相关的不良事件。
为了规避不确定性,FDA增加了额外的规则,通过为COVID-19加速试验设置指定检查点来提高安全性。这包括要求研究人员从每个试验的大多数参与者那里收集至少两个月的随访数据,即使早期数据显示有希望的结果,以及接种疫苗后两年的长期安全性和有效性。
“恢复正常”
接下来的挑战是制造和分发疫苗。全面推出可能需要几个月的时间才能获得足够的批量供大众使用;在此期间,有关部门将优先向感染COVID-19风险最高的人群或受疾病影响最严重的风险最高的人群分发疫苗,如卫生保健工作者、老年人、已有疾病的成年人和基本工作人员。
随着新疫苗的分发,临床试验将继续进行,有关其长期有效性和任何潜在安全问题的数据将继续流入。这将允许研究人员和医疗保健提供者根据需要调整分发。
实际上,公众可能要到今年夏天的某个时候才能获得疫苗。这远远晚于曲速行动最初的目标,即到明年1月提供3亿剂疫苗,但比其他任何行动都要快得多疫苗开发力气日期。
有兴趣参加正在进行的COVID-19疫苗试验的个人,包括未来可能的新候选疫苗试用-可在covidvaccinestdies.uchicago.edu上注册芝加哥大学医学院COVID-19疫苗注册中心。
进一步探索