Moderna要求美国和欧洲监管机构批准其病毒注射
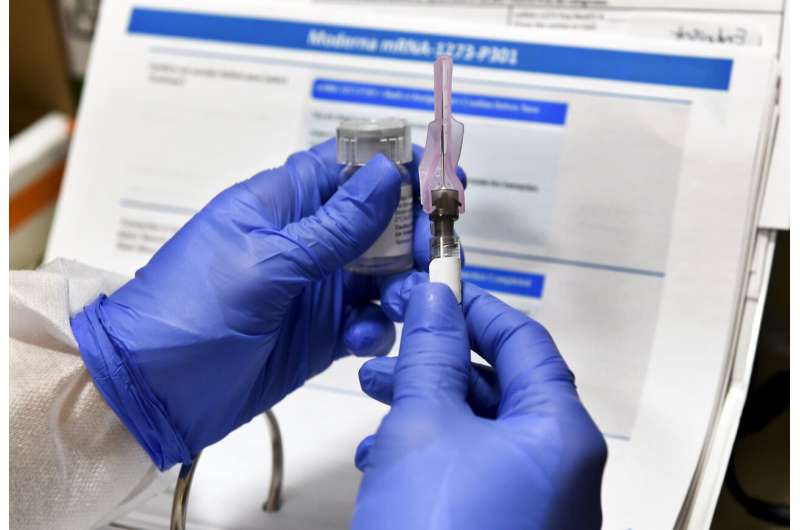
Modioa Inc.星期一表示,它要求美国和欧洲监管机构允许新的研究结果应急使用其Covid-19疫苗作为新的研究结果,确认镜头提供强烈的保护 - 随着冠状病毒横冲直调的疫苗接种,加强血管疫苗。
多种候选疫苗必须获得成功,才能在全球范围内消灭这场大流行。美国和欧洲的疫情一直呈上升趋势。由于美国每天新增病例超过16万,每天死亡人数超过1400人,美国的医院已经被逼到了极限。自近一年前在中国首次出现以来,该病毒已在全球造成140多万人死亡。
Moderna紧随辉瑞及其德国合作伙伴BioNTech之后,于12月在美国开始接种疫苗。英国监管机构也在评估辉瑞和阿斯利康的另一种疫苗。
Moderna是与美国国立卫生研究院(U.S. National Institutes of Health)合作开发疫苗的,目前已经有迹象表明这些疫苗正在发挥作用,但该公司说,上周末获得了所需的最终结果,结果显示疫苗的有效性超过94%。
到目前为止,该机构在美国进行了一项大规模研究,在196例COVID-19病例中,185名试验参与者接受了安慰剂,11名接受了真正的疫苗。该公司位于马萨诸塞州剑桥市的首席医疗官塔尔·扎克(Tal Zaks)医生说,只有30名参与者病情严重,其中一名已经死亡,他们注射的是假针。
当他得知结果时,“我第一次允许自己哭了,”扎克告诉美联社。“我们已经,就在试验阶段,已经拯救了很多生命。想象一下,这种影响会成倍增加到能够接种这种疫苗的人身上。”
Moderna说,这些疫苗的有效性和迄今为止良好的安全记录——只有暂时性的类似流感的副作用——意味着它们符合美国食品和药物管理局(U.S. Food and Drug Administration)制定的在最后阶段测试完成前紧急使用的要求。欧洲药品管理局(European Medicines Agency,欧洲版FDA)已经表示,它也对更快的“有条件的”许可持开放态度。
Anthony Fauci博士,美国传染病专家最高的美国,称为保护水平“非凡。”但是,在提前几个月前,直到足够的疫苗到达,他恳求美国人坚持面具和其他关键的公共卫生措施。
“我们必须继续做一致和统一,直到我们得到的全部或大部分国家接种疫苗和有足够的群体免疫,我们可以粉碎这个爆发,“Fauci告诉美联社,疫苗,“碎天花,我们粉碎了小儿麻痹症,我们粉碎了麻疹,“但对COVID-19需要时间做同样的事。
接下来会发生什么
FDA已经承诺,在决定推出任何Covid-19疫苗之前,其科学顾问将公开争论是否有足够的证据表明每个候选人背后都有足够的证据。
首先于12月10日,辉瑞和比翁技术将呈现患者疫苗候选人的数据95%有效。Modgea表示,它在这个“科学法院”的转折,预计将在12月17日之前完全一周。
配给初始剂量
如果FDA允许紧急使用,Moderna预计将在年底前为美国准备2000万剂。接受者需要两剂,所以这足够1000万人使用。
辉瑞预计到12月全球将有5000万剂疫苗。其中一半——或者说足够1250万人使用的资金——被指定用于美国
出货量设定为在FDA清关24小时内开始陈述。本周,由疾病控制和预防中心设立的不同小组的美国专家小组将会举行决定如何发出初始供应。他们预计将为医疗工作者保留稀缺的剂量,如果镜头在虚弱老人工作足够好,对于长期护理设施的居民。
随着未来几个月越来越多的疫苗供应,其他重要的工作人员和冠状病毒高风险人群将排队等候。但至少要到春季才能满足美国普通人口的需求。

扎克表示,在美国之外,Moderna的大量供应将在明年“第一季度”晚些时候供应。
他说:“很明显,我们正在尽一切努力提高能力,加快进度。”
英国政府周日表示,已向Moderna订购了700万剂。
U.K.还订购了4000万剂的辉瑞 - Biontech疫苗,尽管目前尚不清楚这些公司有限的12月有限的供应,如果英国卫生当局清除镜头。尽管如此,英国医院仍在为下周提前准备一些剂量。
Moderna和辉瑞的疫苗都是用同样的技术制造的,使用的是植入病毒的“刺突”蛋白的一段遗传密码。信使RNA,或信使RNA,指示身体制造一些无害的突刺蛋白,训练免疫细胞识别它,如果真正的病毒最终出现。
Astazeneca混乱
阿斯利康(AstraZeneca)和牛津大学(Oxford University)上周公布了来自英国和巴西研究的候选疫苗的令人困惑的早期结果。
这种疫苗在按原定计划进行测试时的有效性为62%,接种者接受了两剂完整的疫苗。但由于生产失误,一小部分志愿者接受了较低剂量的第一剂疫苗——阿斯利康公司在这一组中说,疫苗的有效性似乎达到90%。
专家说,目前还不清楚为什么低剂量的方法效果更好,这可能只是统计学上的一个怪癖。
一项关于阿斯利康候选药物的更大规模的美国研究仍在进行中,最终将使FDA更好地了解它的疗效。FDA曾表示,任何新型冠状病毒疫苗的有效性必须达到50%以上。
与此同时,英国政府将不得不决定是否是您的u.k.数据是否足以进行那里的早期推出。
还在筹备中
强生公司(Johnson & Johnson)也在美国和其他几个国家进行最后阶段的测试,以确定其候选疫苗是否可以只用一剂。
J&J和AstraZeneca疫苗通过使用无害的冷病毒使用无害的冷病毒将尖刺蛋白基因携带到身体中并使免疫系统素。
不同的技术对不同疫苗在全球分销的容易程度产生了影响。阿斯利康的疫苗不需要像辉瑞和Moderna的疫苗那样需要冷藏。
使用其他技术制作的候选产品也处于后期测试阶段。另一家美国公司诺瓦瓦克斯公司(Novavax Inc.)周一宣布,已经完成了在英国的一项晚期研究的招募工作,并计划“在未来几周内”开始招募更多志愿者参加在美国和墨西哥的最终测试。
三家中国公司和一家俄罗斯公司生产的疫苗也正在世界各国成千上万人身上进行测试。
©2020相关的压力机。版权所有。未经许可,可能不会发布,广播,重写或重新分配此材料。












用户评论