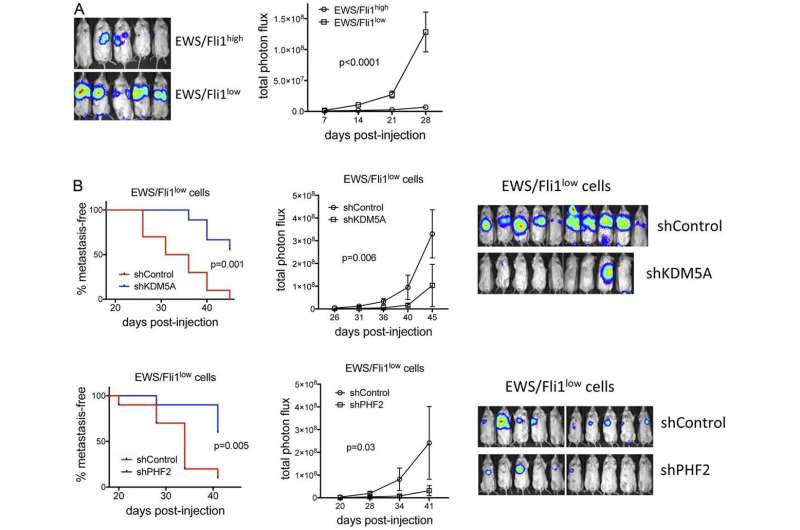
KDM5A和PHF2积极控制亲转移基因的表达
表观遗传机制目前替代的靶向机会,但它们对育种肉瘤转移和疾病进展的贡献仍然明白。
在这里,作者表明,表观遗传调节剂KDM5A和PHF2在ewing中促进生长和转移性肉瘤,令人醒目的,激活表达许多由EWS / FLI1抑制的促型转移基因。这些基因包括L1CAM,其与EWINGSARCOMA的不良结果有关,并促进迁移和侵袭性。
KDM5A和PHF2在更加迁移的高效EWS / FLI1LOW中保留其增长促进效果细胞,PHF2促进这种细胞群中的侵袭和L1CAM表达。
这些研究在一起,鉴定KDM5A和PHF2作为新型疾病促进因子,以及潜在的新靶标,在eWINGSARCOMA中,包括更加迁移的EWS / FLI1LOM细胞群。
Paul Jedlicka博士从科罗拉多大学丹佛说,“EWING SARCOMA,儿童和年轻成年人的第二个最常见的骨骼和软组织癌,是一种生物学和临床侵袭性恶性肿瘤,具有强烈的转移趋势和长期结果差。“
通过这些和其他机制,EWS / FLI1和相关的融合效应了基因表达中的急剧改变,这导致异常细胞增殖和存活,并且对于肿瘤引发是必要的。
虽然EWS / FLI1作为异常细胞增殖的驱动器的作用,但成熟,致癌性转化和肿瘤生长是很好的,但是关于基础肉瘤的高转移性倾向的机制,众所周知。
值得注意的是,虽然EWS / FLI1对某些促体转移基因和途径产生阳性调节控制,但多项研究表明,平衡,EWS / FLI1对蜂鸣肉瘤中的重要转移性能施加抑制作用。
即,EWS / FLI1:抑制体外细胞粘附,运动和侵袭;抑制许多转移促进基因的表达;在体内尾静脉注射模型中抑制器官定植和转移发育。
有趣的是,最近的研究表明EWS / FLI1表达在患者衍生的细胞系和肿瘤中定量异质,具有表达高EWS / FLI1水平的一些细胞,以及一些表达低水平的细胞。
“Jedlicka Research团队在他们的野生动物研究论文中得出结论,我们的研究揭示了存在的存在表观遗传机制在ewing sarcoma中“










用户评论