如何理解酵母朊病毒朊病毒的动态可以在神经退行性疾病上揭示
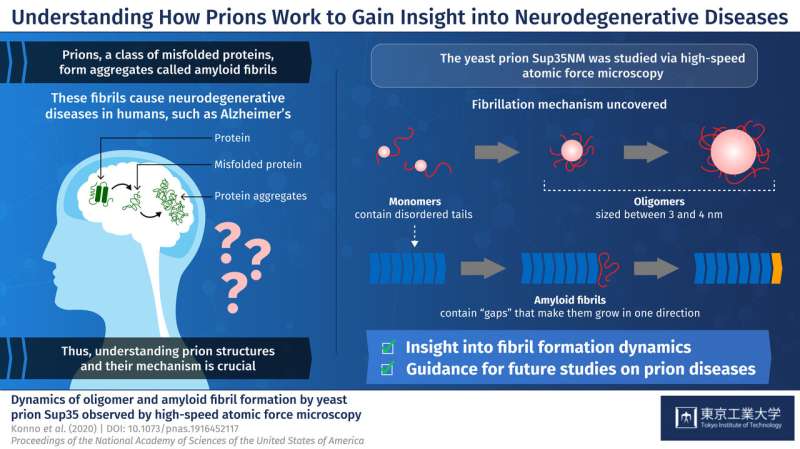
朊病毒是一类错误折叠的蛋白质,形成称为淀粉样蛋白原纤维的聚集体。这些聚集体是像阿尔茨海默氏症等重症哺乳动物神经变性疾病背后的主要罪魁祸首。是什么使它们如此致命的是,它们能够将其错误构象传递到其他健康的蛋白质,导致细胞功能不平衡。目前,致命朊病毒疾病没有有效治疗,主要是因为研究哺乳动物朊病毒是挑战性的。因此,科学家们已经转向酵母等复杂的生物体中的学习朊病毒,这可以提供更多关于哺乳动物朊病毒的洞察力。酵母朊病毒朊病毒朊病毒朊病毒朊病毒杂交也是已知形成淀粉样蛋白原纤维。但尚未理解单个sup35nm分子,称为单体,组合形成淀粉样蛋白原纤维的过程。此外,Sup35NM单体有时会形成称为低聚物的较小结构 - 另一种尚不清楚的方法。对朊病毒相关疾病的阐明,了解如何从朊病毒形成淀粉样蛋白原纤维的确切细节是至关重要的。
在发表的新研究中pnas.,来自东京理工学院和卡泽瓦大学的研究人员由Hideki Taguchi教授展示挖掘进入朊病毒结构及其机制。他们使用了一种叫做现代显微镜技术高速原子力显微镜(HS-AFM)由Toshio Ando博士在Kanazawa大学开发,可视化Sup35nm的形成淀粉样蛋白原纤维实时。Taguchi教授解释说:“先前的研究使用不允许同时,高分辨率评估Sup35NM Oligomerization和Mibrillation的结构和动力学的方法。为了克服这种限制,我们使用了HS-AFM,这允许直接可视化蛋白质分子以高分辨率的动态动作。“
首先,研究人员使用HS-AFM分析了Sup35NM单体。他们的分析表明,Sup35NM分子含有具有两个高度灵活的尾部结构的球状结构。然后,为了观察Sup35nm的低聚形式,在受控条件下在变性溶液中温育单体,在几个小时内导致寡聚体的形成。此外,HS-AFM分析显示了这些低聚物的精确尺寸 - 最多3-4nm,而不是比这更长。因此,科学家推断,这种尺寸可以是这些条件下的低聚物的固有性质。
然后研究人员继续研究Sup35nm的原纤维形式。与低聚物相反,原纤维需要较长的孵育时间来形成,通常是两至三天。此外,研究人员观察到,原纤维在没有低聚物附着的情况下平滑地伸长。这些发现表明,Sup35nm的低聚物不是形成的先决条件淀粉片原纤维,引导科学家得出结论,低聚物实际上可能具有与Sup35nm的细胞功能不同。
最后,研究人员研究了一种有趣的现象,其中低聚物和原纤维结构似乎保持了间隙距离或“间隙”。他们观察到原纤维的躯干具有刚性结构,其排斥来自侧面的低聚物。同时,原纤维尖端与附近的低聚物之间的间隙不太明显,因为尖端没有这种刚性结构。这有助于科学家了解为什么Sup35nM淀粉样蛋白原纤维总是在直线方向上生长而不形成任何分支。
总而言之,这些发现提供了一种详细的账户,进入其单体,低聚和原纤维形式的酵母朊病毒的结构和功能特征。“我们的HS-AFM观察Sup35nm的Sup35nm动态的特征,为淀粉样蛋白提供机械洞察力原纤维形成,“Taguchi教授得出结论。
这种新的洞察力吗?结构体朊病毒机制带来了希望对人类神经退行性疾病有效疗法的希望?只有时间才能告诉,但这项研究对该方向迈出了巨大的一步。
进一步探索















用户评论