弄清阿尔茨海默症

科学家的工作任务之一就是解释世界是如何运转的。他们的研究想法可能经常看起来不现实,但事实证明,他们的研究可能真正帮助了我们中的许多人。
Piotr Pieta博士在IPC PAS的研究工作就是这样。他向我们展示了分子这种化合物被认为是阿尔茨海默症的“罪魁祸首”,影响着这些分子与细胞膜相互作用的方式。
IPC的科学家们研究合成的模型细胞膜,建造得尽可能简单,但同时又与在人类的大脑.这些膜只由磷脂的混合物组成(没有受体或其他物质)膜蛋白),从而使研究人员可以只关注各种分子如何影响确保细胞稳定的屏障。“我们想知道-淀粉样蛋白对这些膜到底有什么作用,”皮埃塔博士解释道。“它们会吸附在膜浮出水面,他们是否摧毁或溶解它们,如果他们溶解它们,为什么和如何....?”
有很多问题——答案才刚刚浮出水面。“在我们的研究中,我们成功地监测了-淀粉样低聚物的大小,即由几个淀粉样分子组成的分子。这样,我们就能看到这种尺寸如何影响它们与模型膜相互作用的机制,”皮埃塔博士说。在对阿尔茨海默氏症的最初研究中,研究对象是患病或实际上已经死于该疾病的人的大脑。大脑中含有长丝状的纤维,许多年来人们一直认为这些纤维是主要的病原体。

然而,最近的研究,包括皮耶塔博士所做的研究,却显示出了另一种情况。罪魁祸首并不是长纤维,而是它们的前体-淀粉样蛋白的低聚物。淀粉样蛋白在我们每个人体内都是由膜蛋白连续产生的,它们被酶切断。当调节它们数量和“外观”的机制停止工作时,问题就出现了。无毒的淀粉样蛋白含有39-43个氨基酸,其二级结构为α -螺旋(一种有点类似DNA链的形状)。“坏的”,改变的结构看起来有点像手风琴折叠。最糟糕的是那些含有42个氨基酸分子的。
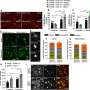
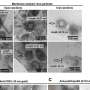
“使用原子力显微镜我们完成了两种类型的测量,一种是直径约2纳米的小齐聚物,另一种是直径约5纳米的稍大的齐聚物,”科学家解释说。“事实证明,小的低聚物与大的低聚物的作用方式完全不同。”大的纤维在膜上沉积后聚集形成长纤维。在它们的参与下发生的所有现象都发生在模型细胞膜的表面,不会导致膜的破坏。
小寡聚物则是完全不同的情况。它们会破坏细胞膜。“一开始,它们在膜上制造出各种大小和形状的洞,”皮埃塔博士解释说。“一旦钻了一个孔,小齐聚物进入膜,并与膜磷脂分子一起形成球状胶束。这些胶束复合物向外扩散,从而从膜上去除磷脂并导致其溶解。与膜的相互作用机制随寡聚物大小的变化而变化。
然而,在两种淀粉样蛋白的情况下,这种相互作用导致膜的机械耐久性下降约50%。换句话说,小的和大的低聚物都是有毒的,尽管它们的作用机制不同。研究人员解释说:“我们的研究解释了这些机制,并调和了文献中发表的相互矛盾的报告。”
“目前,我们只是在解释其基本机制,”皮埃塔博士说,“但在我们研究的下一阶段,我们将向这个系统添加药物分子,看看哪些药物分子可以改变淀粉样蛋白与膜的相互作用,从而可能改变疾病的进程。例如,我们将研究一些分子,它们可以在β -淀粉样蛋白破坏细胞膜之前附着在β -淀粉样蛋白上,从而使其失活。我们已经开始与药剂师和生物化学家合作。我们可以向他们建议,他们的药物是否与膜表面的淀粉样蛋白相互作用,如果是,在什么程度上,它们应该如何表现,例如,为了增加持久性细胞膜科学家总结道。
在IPC PAS进行的研究肯定将有助于更好地理解导致阿尔茨海默病的机制,并可能因此彻底改变该疾病的治疗方式。