近距离研究人体肠道黏液屏障
我们与在我们的肠被称为肠道微生物组中的微生物收集微生物的互动但复杂的关系。这种复杂的细菌群落破坏了不同的食物组分,并释放维生素等营养物质和一种其他因素,这些因素控制在组织方式之外的肠道中的功能。然而,微生物的纯粹数量也存在威胁,因为它们可以引发炎症,这被认为是许多肠疾病的根源,包括炎症性肠疾病,辐射诱导的肠损伤和一些癌症。
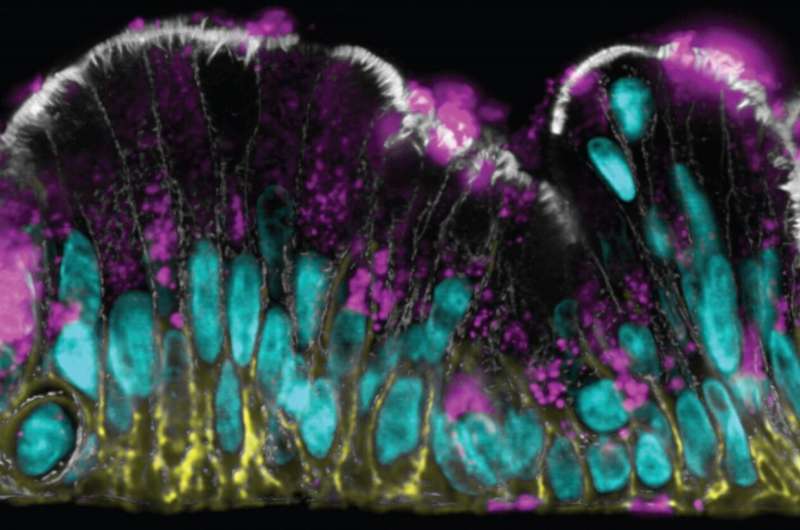
为了让有益物质从肠道腔内摄取,同时防止肠道微生物接触肠道上皮组织表面,专门化细胞叫杯状细胞连续生产粘液,涂层整个肠表面的粘性粘性物质。粘液迄今为止难以研究:它的结构在手术中迅速崩溃了肠道,最常用于研究粘液的系统,并且没有体外培养系统能够重构体内粘液层在人体外生物肠道看到的自然结构。增加了这些困难,粘液还与人类和其他物种之间的不同之处,肠道的不同部分,甚至不同的个体。
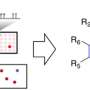
现在,专注于容纳最多数量的共生微生物的大肠或结肠,并拥有最厚的粘液层,在哈佛大学的生物学启发工程研究所的组织工程团队开发了一种芯片(冒号芯片))由患者衍生的微流体培养装置结肠细胞该厚度,双层结构和通常在正常人体结肠中发现的屏障函数自发地积累粘液层。其模型中的粘膜表面还通过安装快速溶胀反应来响应炎症介质前列腺素E2(PGE2)。他们的调查结果发表在细胞和分子胃肠病学和肝病学。
"Our approach provides researchers with the opportunity to find answers to questions about normal and disease-associated mucus biology, such as its contributions to intestinal inflammatory diseases and cancers, and complex host-microbiome interactions," said Founding Director Donald Ingber, M.D., Ph.D., who is the senior investigator on the study. "Importantly, we use patient-derived cells to line these devices and so this represents an entirely new approach for personalized medicine where it can be possible to study how mucus functions or dysfunctions in a particular patient, and to tailor therapy accordingly."
Ingber还是哈佛医学院和波士顿儿童医院血管生物学项目的Judah Folkman教授,以及哈佛大学约翰A.保尔森工程与应用科学学院的生物工程教授。他的团队是由英国癌症研究大挑战基金支持的多机构合作的一部分,在该合作中,他的Wyss团队研究了炎症相关的变化如何促进癌症的形成,包括结肠癌。“大挑战”是一项雄心勃勃的国际癌症研究计划,支持世界领先的科学家团队接受一些癌症方面最艰巨的挑战,并给予他们大规模尝试新方法的自由。
该团队的方法与来自结肠切片和内镜活组织检查的患者衍生的结肠细胞开始,所述内窥镜活组织检查是首先生长为“有机骨”,微小有组织的结肠组织的结肠组织,其含有主要上皮干细胞。在片状片段后,它们的细胞用于填充由多孔膜分离的微流体芯片的两个平行通道的荧光。只需用营养培养基连续灌注通道,结肠干细胞生长到连续片中并形成分泌粘液的高官能脚卵细胞。
“在流动的片上生长细胞导致大约15%的上皮细胞自发地分化为脚卵细胞。分布在整个上皮内,这些产生体内类似的粘液层第一作者Alexandra Sontheimer-Phelps说,她是德国弗莱堡大学的研究生,在Ingber的小组工作。“与此同时,其他不断分裂的上皮细胞也像活结肠一样补充杯状细胞,这意味着芯片可以在稳定状态下维持两周以上,这使得它非常适合长期研究。”
Wyss团队表明芯片中的结肠上皮完全偏振,并限制其腔暴露,粘液分泌侧及其相对的膜结合侧的不同标记。它的脚卵细胞分泌着主要的粘液蛋白粘蛋白2(MUC2),当与复合链的糖分子连接时,组装成占用水的多分子网络或凝胶。“我们的方法实际上产生了具有内致密层的正常结肠粘液的双层结构,即我们展示潜在的含有肠道通道的细菌模仿颗粒,以及更宽的外层,允许颗粒进入。这从来没有在体外完成,“Sontheimer-Phelps说。
为了研究黏液的功能,她和她的同事将芯片暴露在炎症介质PGE2中。黏液在数分钟内迅速膨胀,且不受任何新的黏液分泌的影响。在活体培养中,黏液积累的过程可以通过在暗视野下观察切片的侧面来观察。这种动态响应可以通过抑制一个特定的离子通道来阻断,该离子通道将离子泵入冒号上皮和被动地允许水分子遵循,显然,当被诸如PGE2的信号刺激时,这会驱动粘液肿胀。
黏液长期以来一直被认为是一种被动的宿主屏障,但越来越清楚的是,微生物物种除了以其碳水化合物为能量来源外,还影响其结构和功能。“我们的体外系统让我们离弄清楚单个细菌物种和更复杂的微生物群落是如何影响人类的又近了一步粘液反之亦然,以及这种复杂的相互作用如何影响肠道疾病的发展。我们现在还有一个试验台,以发现可能预防或逆转这些疾病的新治疗药物和益生菌策略“夹木。







用户评论