ZEB1调控治疗靶点,保护kras突变肺癌
德州大学MD安德森癌症中心的研究人员今天在《癌症》杂志上报道,细胞身份开关保护癌症促进基因通路免受靶向治疗的影响科学转化医学。
工作在细胞系还有小鼠肺模型癌症由胸/头颈部医学肿瘤学副教授Don Gibbons, M.D, Ph.D.领导的团队展示了kras驱动的肺癌细胞如何通过从稳定的、固定的细胞转换为与胚胎发育相关的一种可移动的、耐药的细胞而战胜治疗。他们还发现了一种药物组合,可以逆转这种细胞转变,恢复对靶向治疗的脆弱性。
大约30%的癌症都有KRAS的激活突变,而KRAS会引发癌症肿瘤起始通过一个信号通路叫MAPK。虽然KRAS本身还没有被药物成功地攻击,但MEK的靶向治疗已经被开发出来。MEK是KRAS在促癌MAPK级联中触发的下游蛋白之一。
“MEK抑制剂已经在多种临床环境中进行了试验,包括肺癌,结果并不好,”吉本斯说。“它们对KRAS突变患者并没有持续有效,原因也不清楚。”
吉本斯和他的同事们通过MD安德森的肺癌登月计划(Moon Shots Program的一部分)着手确定耐药性机制,这是一个合作努力,旨在将科学发现加速发展为挽救患者生命的临床进展。
触发上皮细胞转入危险的间充质状态
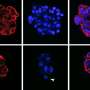
一系列细胞系实验和体内筛选显示,肿瘤中的某些细胞存在KRAS突变和激活MAPK信号,这使得它们可能容易受到MEK抑制。这些上皮细胞这些线或覆盖着身体的器官,不能移动,只能执行特定的功能。
第二组实验证实,MAPK信号是由一种名为ZEB1的蛋白质调控的,ZEB1抑制IL17RD蛋白,在KRAS突变的情况下关闭信号通路。ZEB1的表达将上皮细胞转变为一种不同的细胞类型-间充质细胞。
这种类型的间充质细胞在正常情况下处于活动状态胚胎发育吉本斯解释说。当胚胎干细胞产生发育中胚胎所需的所有细胞类型时,上皮细胞呈现出一种间充质形式,例如,允许一个肺细胞运动加入其他肺细胞。一旦就位,这些细胞就会恢复到上皮细胞的形态,并形成器官。
吉本斯说:“间充质细胞在胚胎发生过程中具有非常高的迁移和侵袭能力,因为它们具有正常的功能。”“这个程序被称为上皮细胞到间充质转化(EMT),已知在肿瘤的发展和发展过程中被激活。”
长期以来,成人细胞胚胎发育过程的激活与癌症的进展和转移有关,这也是吉本斯实验室的研究重点。
“你取一个具有正常功能的分化良好的上皮细胞,无论是肾细胞、肺细胞还是乳腺细胞,它们都有功能,并且有明确的定义。突然间,你打开了特定的EMT基因集合现在这些细胞的行为就像一个5岁的孩子而不是一个成人的细胞因为它们不再以同样的方式管理。他们跑开,开始以一种不典型的方式行事。这就是癌症的缩影。”吉本斯说道。
当KRAS突变的上皮或间充质型肺癌小鼠模型被MEK抑制剂治疗时,间充质细胞从一开始就具有耐药性。上皮细胞最初反应良好,但随着时间的推移,超过80%的肿瘤产生了耐药性。
吉本斯说:“那些产生耐药性的肿瘤经历了上皮细胞向间充质细胞的强大转变。”
逆转EMT,恢复MAPK
此前其他实验室的研究表明,一种名为组蛋白去乙酰化酶(HDAC)抑制剂的药物可以逆转EMT,使间充质细胞恢复为上皮细胞。在这项研究中,使用HDAC抑制剂治疗细胞可以抑制ZEB1,逆转EMT,恢复MAPK活性,使肿瘤对MEK抑制剂变得脆弱。
HDAC抑制剂和MEK抑制剂联合治疗可使小鼠肿瘤急剧缩小。
对几个人类肿瘤大数据集的分析证实了ZEB1和MAPK通路活性之间的负相关。
该团队正在进行联合治疗来攻击上皮细胞和间充质细胞的工作。
“间充质细胞对MEK抑制剂不敏感,即使它们有KRAS突变,”吉本斯说。“如果它不是通过MAPK发出信号突变的KRAS通过什么发出信号,它的生存依赖什么?”
研究还侧重于将MEK抑制剂与免疫检查点抑制剂结合,从而对肿瘤发动免疫攻击。免疫疗法已经对肺癌产生了重大影响,并可能改变MEK治疗的细胞耐药性动态。
进一步探索













用户评论