两种蛋白质的组合在帕金森病中施加再生效果
帕金森病是目前是第二次普遍的神经源性病理学。它是一种由大脑灰质物质中失去多巴胺能神经元引起的电机障碍。这些神经元产生多巴胺,是一种神经递质,在不自主运动的调制中起着关键作用。
在UPV / EHU进行的研究是在一种实验模型中开发的,可再现帕金森病的不同阶段。结果表明,该病症引起的变化在大脑的不同部位之间不是均匀的。“损害与特定的解剖分布相关联多巴胺能神经元和他们的终端,“研究人员Catalina Requejo说。换句话说,多巴胺能神经元与仍然存在整体的地区有更多联系的那些区域受到影响较小。
确认后实验模型可用于探索疾病引起的形态学和功能变化,应用了基于神经营养因子释放的治疗策略。这些因素是促进细胞生长,可塑性和生存的蛋白质,因此在控制中发挥重要作用神经功能。
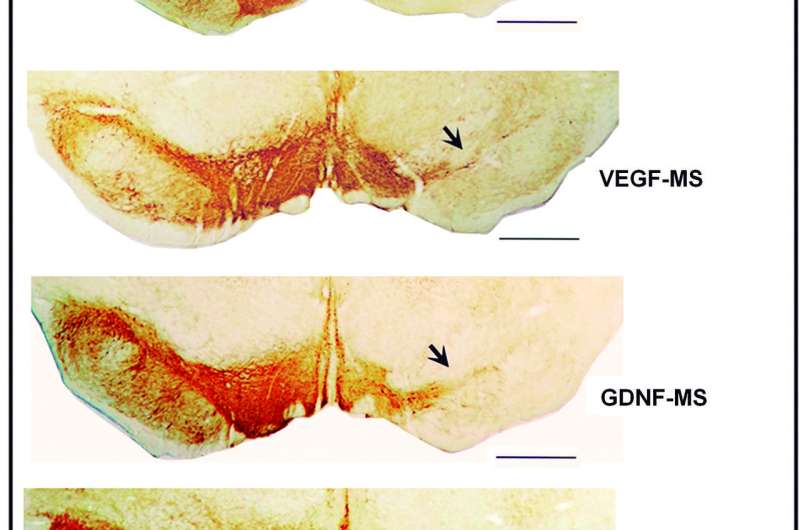
具体而言,研究人员应用血管内皮生长因子(VEGF)和胶质细胞衍生的神经营养因子(GDNF)。将这些分子包封在微球中或纳米球中包封,其包含生物相容性,可生物降解的聚合物:聚乳酸 - 共乙酸(PLGA),其连续且逐渐释放。此外,以组合方式施用因子以确定它们是否诱导协同效应。
结果在模型的早期和严重阶段令人鼓舞。VEGF和GDNF的组合不仅显着降低了多巴胺能的退化神经元的灰质,它还诱导形成新细胞和细胞分化。研究人员还能够证实,该地区的神经纤维预测的区域已经有所改善。为了确认两个因素的协同,神经源性效果,它们给予抑制他们正在研究的两个神经营养因素的受体的分子。“多巴胺能系统的后果甚至更差,这支持野兽野兽和帕金森施工的有益协同效应,”研究人员结束。
最后,值得突出显示在模型中疾病的早期阶段送入纳米球中封装的因素时获得了最佳结果。这加强了早期诊断的重要性,“纳米技术可能是一个非常有用的工具,当涉及到管理时神经营养因子,“ 她说。











用户评论