接近一个几十年的目标:使血液干细胞来自患者自己的细胞
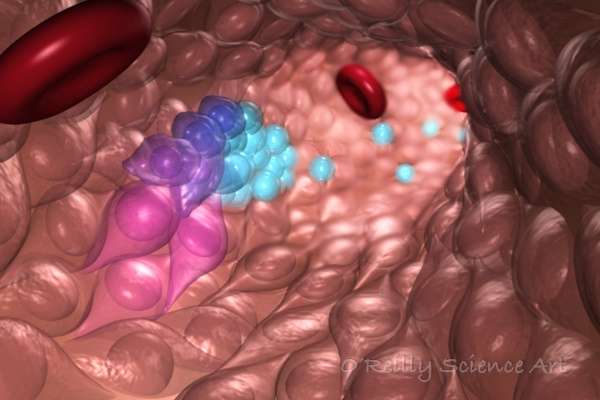
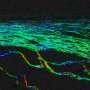
波士顿儿童医院的研究人员,第一次生成造血干细胞在实验室使用多能干细胞,使体内几乎所有的细胞类型。进步,今天发表在《华尔街日报》自然,打开新途径研究血液疾病的根源和创建immune-matched血液细胞治疗目的,来自患者自己的细胞。
“我们正在步步走近生成真正的人类血干细胞在培养皿中,”高级研究员乔治·戴利说,医学博士,他领导着一个研究实验室在波士顿儿童医院的干细胞项目和哈佛医学院的院长。“这项工作是经过20多年的努力。”
虽然细胞由多能干细胞的真爱如血干细胞和其他细胞被称为血祖细胞,他们被证明能产生多种类型的血细胞的时候放入老鼠。
”这一步打开了一个机会,把细胞从遗传血液疾病,患者使用正确基因编辑他们的基因缺陷,使功能血细胞,“说Ryohichi Sugimura(力拓),医学博士,博士,这项研究的第一作者和博士后戴利实验室。“这也让我们有无限的潜力的血液干细胞和血液供应通过细胞普遍的捐助者。这可能会增加病人需要输血的血液供应。”
结合两种方法来实现一个突破
因为人类胚胎干细胞(ES)细胞被孤立在1998年,科学家们一直在努力,但收效甚微,使用它们,使造血干细胞。2007年,三组(包括戴利实验室)生成的第一个诱导多能干细胞(iPS)细胞人类皮肤细胞通过基因重组。“诱导多能性”细胞后来被用于生成多种人类细胞类型,例如神经元和心脏细胞造血干细胞仍然难以捉摸。
Sugimura,戴利和同事结合前两个方法。首先,他们暴露了人类多能干细胞(ES和iPS细胞)化学信号直接干细胞分化成专门在胚胎发育正常的细胞和组织。这个生成hemogenic内皮,早期胚胎组织,最终导致血液干细胞,虽然过渡到血液干细胞在培养皿中从未实现。
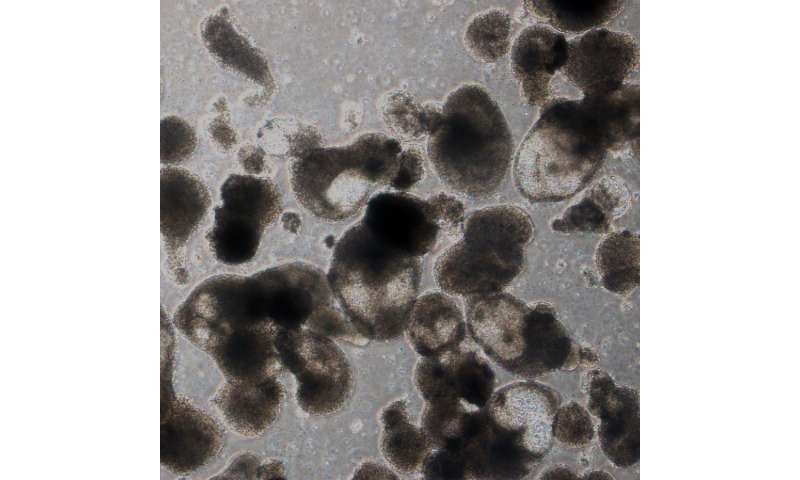
在第二步中,团队添加基因监管因素(称为转录因子)将hemogenic内皮对造血的状态。从26日开始转录因子确定为可能的候选人,他们最终下来只有5 (RUNX1、ERG、LCOR HOXA5和HOXA9)都是必要且充分的用于创建血液干细胞。他们交付的因素与慢病毒进入细胞,用于某些形式的基因治疗。
最后,他们将转基因hemogenic内皮细胞移植到老鼠。周后,少量的动物进行多种类型的血细胞的骨髓和血液循环。这些包括红细胞前体,髓细胞(单核细胞的前体细胞,巨噬细胞、中性粒细胞、血小板和其他细胞),和T和B淋巴细胞。一些老鼠能够挂载人类接种疫苗后的免疫反应。
胚胎干细胞和诱导多能干细胞同样擅长创造血液干细胞和祖细胞的技术应用。但是研究者最感兴趣的“诱导多能性”细胞,提供额外的能力获得细胞直接从病人和疾病模型。
“我们现在能够模型人类血液函数在所谓人性化的老鼠,”戴利说。“这是一个重大的进步我们调查遗传血液疾病的能力。”
血干细胞是什么?
研究者的技术生产的所谓血液干细胞和造血祖细胞,也产生血细胞。他们的终极目标是扩大自己的能力让真爱如血干细胞的实用和安全的,不需要病毒提供转录因子,并引入基因编辑技术CRISPR纠正基因缺陷多能干细胞在血细胞。
在真实的人类血液干细胞的一个挑战是,没有人能够完全描述这些细胞。
“这是证明具有挑战性的“看”这些细胞,”Sugimura说。“你可以大致描述血液干细胞表面标记的基础上,但即使这样,它可能不是一个真正的血液干细胞。一旦它开始分化,使血细胞,你不能回去研究它已经不见了。一个更好的人类血液干细胞的特征细胞和更好的理解他们如何发展会给我们线索做出善意的人造血干细胞。"
进一步探索