研究人员设计了主要止痛药受体的变体
阿片类药物,如吗啡,仍然是最有效的止痛药,但它们会带来副作用,高剂量时也会上瘾和致命。设计这种类型的新止痛药需要在相应的受体上进行测试,但要获得大量能在实验条件下发挥作用的受体一直是一个限制因素。
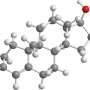
现在,一个跨学科合作宾夕法尼亚大学的研究人员已经开发出了一种变异Mu阿片受体当涉及到实验时,这有几个优势。这种变体可以在细菌中大量生长,也可溶于水,使以前非常具有挑战性或不可能实现的实验和应用成为可能。
该研究由Renyu Liu领导,由宾夕法尼亚州佩尔尔曼医学院的麻醉学和批评教授,艺术和科学学院化学系副教授Jeffery Saven担任助理教授。然后何塞·曼努埃尔佩奎拉尔,然后是化学系的研究生,以及麻醉科和徐翠,徐翠,在麻醉科和关键护理部门的实验室成员以及伯纳德销售影响生物公司,大大贡献这项研究。
他们的研究发表在《华尔街日报》上《公共科学图书馆•综合》。
阿片受体属于一类细胞膜蛋白称为G protein-coupled受体或GPCRs。这些受体参与广泛的生物过程,与环境中的分子结合,启动细胞信号通路。在这种受体的情况下,与阿片类分子结合可以极大地减轻疼痛,但也会产生各种不愉快的、可能致命的副作用,这是多个学科的研究人员正在试图解决的问题。
“在基础科学中解决这个问题有两个方向,要么致力于阿片类分子,要么致力于受体,”刘说。“我们做的是后者。”
阿片受体的实验具有挑战性,原因有几个。人体受体本身相对稀少,只在少数几种细胞上少量出现,因此获得可观数量的受体是不现实的。研究人员也无法重组这种蛋白质——通过基因工程细菌来大规模表达这种蛋白质——因为蛋白质的某些部分是有毒的大肠杆菌。受体外表面的疏水性或疏水性氨基酸基团帮助受体停留在细胞膜上,当分离时也使受体不溶于水。
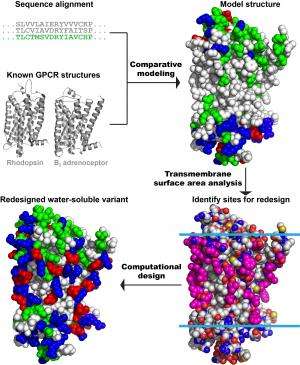
研究人员开始着手解决这些挑战,通过计算设计的变体μ阿片样物质受体。这项任务有自己的挑战;在已知受体的晶体结构之前,他们的研究是长期进行的。
“这个受体的问题是,自然结构直到最近才被解决,只有一个重大的重新设计的小鼠模型,”刘说。“当我们开始这个项目时,我们是盲人。”
从人类版本的受体基因序列开始,研究人员知道蛋白质氨基酸的顺序,但不知道它们是如何折叠在一起的。然而,其他GPCRs的结构,如视紫质和β -2肾上腺素能受体,当时已经知道了。
Saven说:“基于对我们的序列和那些GPCRs序列的比较,我们建立了一个蛋白质的计算机模型。”“当这种受体的老鼠版本的结构出现时,我们能够将我们的模型与那种结构进行比较,它们非常匹配。”
从该比较来看,研究人员能够鉴定结构外部的疏水性氨基酸,以及一些潜在毒性的氨基酸大肠杆菌。
“当时的目标是重新设计这些外部氨基酸,”Saven说。“基于这些氨基酸彼此之间以及与水之间的物理和化学相互作用,我们能够识别出与模型一致的序列组合,即原子在空间中不重叠,并优先与水溶性的原子占据表面。”
替换了288个蛋白质中的53个氨基酸,该研究小组将新的基因序列引入大肠杆菌该公司能够生产大量的这种变体。除了看起来像现在可用的鼠标mu阿片受体,研究人员能够通过功能测试显示其对未来研究的价值。
“我们表明,当与荧光标记的抗拮抗剂结合时,这种水溶性蛋白质的蛋白质可以与基于膜的形式竞争,”Saven表示。“随着更多这些水溶性变体在溶液中漂浮,您可以观察荧光变化。”
该团队的计算方法使变体的进一步迭代更容易设计,这意味着它可以根据实验条件进行调整。
“这是一个很好的产品,可以做很多东西,”刘说。“您可以使用此变体来查看接收器的结构功能关系,甚至可能将其用作筛选工具。”
进一步探索










用户评论