猪的囊性纤维化模型提高了对疾病的理解
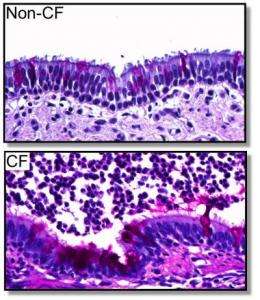
已经20多年以来,科学家们首次发现的基因导致囊性纤维化(CF),然而关于变异的基因是如何引发疾病的问题仍然没有答案。
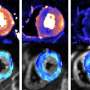
使用新创建的猪模型,基因复制最常见的囊性纤维化,爱荷华州大学的研究人员已经表明CF蛋白质“misprocessed”猪和不正确的移动位置。这种故障导致疾病症状,包括胃肠道异常和肺部疾病在猪、模拟人类CF。研究结果发表在3月16日出版的《华尔街日报》科学转化医学。
早期的实验表明的结果匹配基因突变破坏的过程CF蛋白质折叠成正确的形状和运送到细胞的细胞膜的航空公司和其他器官。
当它正确位于细胞膜,这种蛋白质,叫做囊性纤维化跨膜电导调节器(雌性生殖道)——形成一个通道,允许氯离子进出细胞。这种离子运动的一个关键组成部分的系统维护盐和水平衡跨肺细胞膜以及其他器官和支持正常膜功能包括根除细菌的细胞表面。
在猪身上的新研究显示,雌性生殖道的蛋白质表现出相同的方式在一个活的动物在实验电池系统,这表明这些实验系统是有用的了解雌性生殖道蛋白质的性质。细胞系统和新的猪模型也可能有助于测试疗法旨在增加进入细胞膜的蛋白质,或提高活动的蛋白质位于膜。
”,而不只是试图治疗CF的症状,目前的研究正朝着目标CFTR突变检测基因疗法,”David Stoltz说,医学博士内科医学博士,助理教授UI和高级研究作者。“例如,药物已经被称为“校正”被测试。这些药物帮助其雌性生殖道从细胞内移动到正确的位置在细胞表面。
“猪模型可以帮助我们开发和测试更多的校正器的药物,这也会帮助我们更好地理解为什么蛋白质misprocessed首先,“Stoltz补充道。“如果我们理解错了,我们可以开发新疗法,可以针对这个问题,让更多的雌性生殖道细胞表面,这可能会缓解疾病的症状。”
2008年,创建的UI团队和同事在密苏里大学猪失踪的雌性生殖道的蛋白质。这些动物开发的CF疾病症状密切模仿人类的疾病。在新的猪模型,动物雌性生殖道基因的两个副本包含最常见CF-causing突变,也被称为δF508突变。这些猪也开发CF症状类似于人类疾病。特别是,CF猪天生胃肠疾病和肺部疾病随着时间的发展。
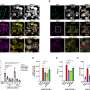
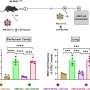
通过研究猪的蛋白质,研究人员能够表明,大部分的雌性生殖道蛋白质misprocessed和退化,但少量的蛋白质并到达细胞膜,它能够形成活性氯通道。然而,活动水平只有6%的活动中发现正常猪CFTR功能齐全的检测通道。研究表明,这种少量的雌性生殖道活动不足以预防CF疾病的猪。
CF是一种隐性疾病,这意味着一个人有一个突变的复制和一个好的副本雌性生殖道的基因是一种“载体”,但没有CF。这表明,50%的正常雌性生殖道活动对健康就足够了。的问题一直是,有少量的活跃的雌性生殖道足以保护人们免受疾病的症状吗?”
“我们知道人们有50%的雌性生殖道功能没有疾病,现在我们知道,6%的全部活动并不足以防止疾病在猪、“Stoltz说。“我们仍然不知道多少雌性生殖道足以防止疾病,但这个模型动物可以给我们进行调查。”