突变喀斯特调节Y染色体基因在结直肠癌,驾驶转移和抑制免疫力

德克萨斯大学MD安德森癌症中心的研究人员已经发现Y染色体上的基因调节的KRAS-mutated结直肠癌(CRC),增加肿瘤细胞侵袭性和降低男性患者的抗肿瘤免疫。
的临床前研究在今天公布,6月21日自然提供了新颖的见解,长期以来神秘的分子和细胞机制驱动增加转移和预后不良与CRC的男人。结果突出了Y染色体基因KDM5D,表观遗传酶编码,作为一个潜在的治疗目标和揭示其非规范功能调节抗肿瘤免疫反应。
“利用实验小说的结直肠癌模型,我们综合计算和功能分析表明致癌喀斯特调节Y染色体基因促进转移和肿瘤免疫逃避男性,“说通讯作者Ronald DePinho医学博士癌症生物学教授。“我们现在有了一个可操作的目标值得进一步调查,提供一个路径拦截,将改变疾病的自然史与KRAS-mutant男人结肠直肠癌。"
长有显著的性别差异的结果患者转移CRC-the第二个最常见的癌症死亡原因男性通常比女性有更高的发生率和糟糕的预测。然而,这些差异的潜在机制可能主要归因于生活方式差异和性激素。
而生活方式的改变可以受益的病人,很多吗临床研究评估激素干预措施改善男性CRC结果产生了负面的或者不确定的结果,强调需要一个更深层次的机械的理解分子的细微差别,开车更激进的男性疾病。
实验室模型揭示性别差异在肿瘤生物学
第一作者Jiexi Li博士DePinho实验室的,领导这项研究的努力和生成转基因小鼠模型,密切反映人类的进化CRC转移性进展,包括模型与致癌喀斯特以及灭活APC和p53肿瘤抑制,最常见的突变CRC患者中发现的蛋白质。
李,最近毕业于休斯顿安德森UTHealth生物医学科学研究生院,发现只有KRAS突变模型显示性别差异,男性表现出更高的转移频率和总生存期比女性短。这让李假设喀斯特是可能司机这些性差异。
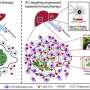
跨物种和转录组分析显示KDM5D高度调节在这些模型,并进一步探索发现的重要参与抑制基因控制细胞粘附和抗肿瘤免疫,促进转移的行为。
KDM5D epigenetically扰乱细胞连接,过渡到转移
最早的步骤在转移和信息枢纽的损失,它允许癌症细胞转换成一个迁徙状态。研究人员发现细胞结AMOT KRAS-mutated表达下调的基因转移性癌模型。
此外,在患者样本,之间存在着负相关AMOT KDM5D表达式从男性肿瘤;AMOT KRAS-mutant CRC细胞系中表达较低的男性比女性。进一步分析表明,KDM5D epigenetically压制AMOT,损害这些细胞连接,使癌细胞转移到转移状态。
在模型中删除KDM5D恢复AMOT水平癌细胞从实验室模型和CRC患者,修复细胞连接和减少癌细胞侵袭性。相反,使用转基因执行KDM5D表达促进肿瘤侵犯没有致癌喀斯特。
KDM5D的小说功能阻碍识别癌细胞的免疫系统
研究人员指出,转移性癌细胞显示特定基因元素称为super-enhancers减少活动,这是参与激活特定基因的转录集群。具体来说,有较低的在抗原表达相关基因的表达主要组织相容性复合体(MHC-1),肿瘤的免疫系统识别的关键机制。之前的研究表明,MHC缺乏可促进肿瘤的免疫逃逸。
这项研究表明,KDM5D压制TAP1 TAP2基因,通常协助处理和呈现抗原T细胞信号消除异常细胞。因此,KDM5D在此设置,使癌细胞逃避和破坏免疫细胞,促进其进展和转移的能力。
“这不仅解释性别差异,但是我们的工作发现了一个全新的生化功能的调节组蛋白乙酰化组蛋白demethylases super-enhancers控制免疫系统的基因,”DePinho说。
更多信息:罗纳德•DePinho组蛋白demethylase KDM5D upregulation导致结肠癌,性别差异自然(2023)。DOI: 10.1038 / s41586 - 023 - 06254 - 7。www.nature.com/articles/s41586 - 023 - 06254 - 7