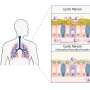
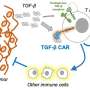
疫苗增强设计的T细胞的反应,可以帮助消除实体肿瘤
工程T细胞破坏癌细胞显示成功治疗某些类型的癌症,如白血病和淋巴瘤。然而,它并没有对实体肿瘤。
缺乏成功的原因之一是,T细胞抗原(只有一个目标靶蛋白发现肿瘤);如果一些肿瘤细胞不表达抗原,他们可以逃避T细胞攻击。
麻省理工学院的研究人员已经找到一种方法来克服障碍,使用疫苗,提高设计的T细胞的反应,称为嵌合抗原受体(汽车)T细胞,以及帮助免疫系统生成新的T细胞这一目标肿瘤抗原。在对小鼠的研究中,研究人员发现,这种方法更有可能,肿瘤可以根除。
”这种疫苗刺激似乎推动这一过程被称为抗原蔓延,在你自己的T细胞的免疫系统与工程汽车拒绝,并不是所有的肿瘤细胞表达抗原的目标车的T细胞,”达雷尔·欧文说,Underwood-Prescott教授预约在麻省理工学院的生物工程和材料科学与工程部门,和麻省理工学院的一个成员的科赫研究所综合癌症研究、MGH雷根研究所正是从麻省理工学院和哈佛大学。
欧文是这项研究的资深作者,它出现在细胞。论文的第一作者是Leyuan马前科赫研究所博士后,目前医学病理学和实验室的助理教授在宾夕法尼亚大学医学院的。
设计的T细胞
美国食品和药物管理局已经批准了几种类型的T细胞治疗血液癌症。这些治疗方法都是基于CAR-T细胞,这是设计来显示受体可以识别特定抗原上发现的癌症细胞。
试图适应这种治疗胶质母细胞瘤,一种脑癌,研究者设计了CAR-T细胞EGFR受体的变异版本目标。然而,并不是所有胶质母细胞瘤细胞表达抗原,当受到CAR-T细胞,胶质母细胞瘤细胞通过停止生产目标抗原的反应。
在2019年的一次研究欧文和他的同事们增强CAR-T对胶质母细胞瘤细胞的有效性提供疫苗的老鼠改造后不久T细胞接种。这种疫苗,相同的抗原CAR-T细胞的目标,被免疫细胞在淋巴结,CAR-T细胞暴露于它。
在这项研究中,研究人员发现,这种疫苗不仅帮助提高工程CAR-T细胞攻击肿瘤,但是它有另一个,意想不到的效果:它帮助生成主机其他肿瘤抗原T细胞这一目标。
这种现象,被称为“抗原蔓延”,是可取的,因为它创造了T细胞的数量,一起工作,可以完全消除肿瘤,防止肿瘤再生。
“这将是完全可以帮你处理抗原的异质性实体肿瘤,因为如果你具备主机其他抗原t细胞攻击,他们也许能够进来CAR-T细胞不能杀死肿瘤细胞,”欧文说。
免疫增强
在新的研究中,研究人员想探讨额外变得激活t细胞反应。他们使用相同类型的CAR-T细胞从他们2019年的研究中,设计针对表皮生长因子受体突变,同样的疫苗。小鼠在研究中有两个剂量的疫苗,一个星期。
研究人员发现,在这些提高了老鼠,代谢变化发生在CAR-T细胞增加了生产干扰素γ、细胞因子,帮助刺激强烈的免疫反应。这有助于克服免疫抑制环境的T细胞的肿瘤,通常关闭任何T细胞在附近。
随着CAR-T细胞杀死肿瘤细胞表达目标抗原,宿主T细胞(而不是工程CAR-T细胞)遇到其他抗原的肿瘤细胞,刺激那些目标主机T细胞抗原和帮助摧毁肿瘤细胞。
没有主机T细胞反应,研究人员发现,肿瘤会再生,即使CAR-T细胞摧毁了大部分的原始肿瘤细胞。这是由于肿瘤细胞治疗CAR-T细胞通常停止生产基因工程细胞抗原的目标,使他们能够逃避这些细胞。
肿瘤根除
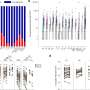
研究人员然后测试他们的方法在小鼠肿瘤靶抗原的不同层次。他们发现,即使在只有50%的肿瘤细胞的肿瘤表达目标抗原,大约25%的肿瘤仍然可以被根除,通过组合CAR-T细胞和t细胞。
肿瘤的成功率更高更高层次的目标抗原。当80%的肿瘤细胞表达抗原的目标CAR-T细胞,肿瘤被淘汰在大约80%的老鼠。
在这项研究中使用的技术已经授权给一家名为Elicio疗法,它正在发展中潜在的测试的病人。在这项研究中,研究人员专注于胶质母细胞瘤和黑色素瘤,但是他们相信它可能被用来对抗其他类型的癌症。
“原则上,这适用于任何实体瘤,你应该生成一辆t细胞可能目标,”欧文说。
研究人员还致力于适应CAR-T细胞疗法,以便它可以用来攻击肿瘤的通道抗原已确定。
更多信息:达雷尔欧文Vaccine-boosted汽车T相声与宿主免疫排斥肿瘤抗原的异质性,细胞(2023)。DOI: 10.1016 / j.cell.2023.06.002。www.cell.com/cell/fulltext/s0092 - 8674 (23) 00642 - 6
这个故事是由麻省理工学院新闻(再版web.mit.edu/newsoffice/),一个受欢迎的网站,包括麻省理工学院新闻研究、创新和教学。