小组还建议FDA批准的第一个鼻喷雾剂对抗严重过敏的攻击
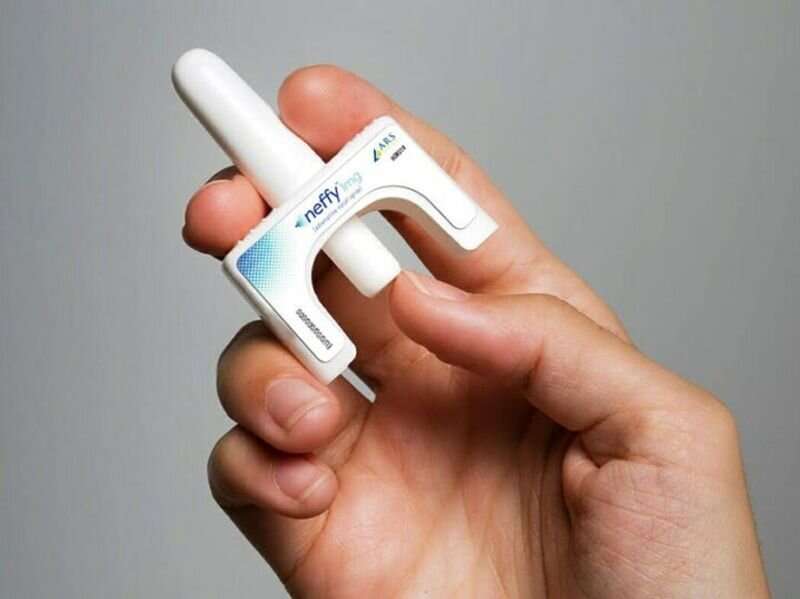
美国食品和药物管理局外部顾问周四投票推荐Neffy批准,第一个肾上腺素鼻喷雾剂对严重过敏反应。
虽然大多数Pulmonary-Allergy药物咨询委员会成员支持的喷雾成人(十六6)和儿童(17:5),关键问题能听到有关是否需要更多数据从它的制造者,ARS制药,CBS新闻报道。
但是Richard Lowenthal称,联合创始人,总裁兼首席执行官在ARS,说公司声明投票后,“我们相信,我们的临床数据来自600多个个人证明Neffy absorption-enhancing喷鼻剂技术与注射产品提供潜在拯救生命的肾上腺素,但具有独特优势的小针头大小、方便。”
Lowenthal补充道,“我们致力于使病人和照顾者更容易携带和管理肾上腺素不与使用needle-based设备相关的焦虑和犹豫。”
Neffy 2-milligram剂量的肾上腺素。而不是大规模临床试验制药公司其产品已批准注射肾上腺素产品相比,比如EpiPen。它显示的结果Neffy既不显著高于或低于注射肾上腺素。
“病人需要选项不同的管理方法,便于实际使用肾上腺素在紧急事件中,“卡洛斯Camargo博士,哈佛医学院急诊医学教授在波士顿,在该公司的新闻发布会上说。
“肾上腺素对血压和心率的影响疗效和代理人是重要决定如果有人回应治疗。Neffy,血压和心率相媲美EpiPen与单一剂量和第二个剂量的Neffy,增加收缩血压在统计学上高,甚至比从EpiPen显示可用的数据,这对病人来说至关重要,要求第二次严重的过敏反应的剂量,”Camargo补充道。
通过注射肾上腺素自1901年以来一直使用。从来没有把现在通过药物审批过程一样,因为它是市场上之前FDA存在,CBS新闻报道。
这意味着FDA没有大量的数据可以使用比较Neffy的有效性在拯救病人有严重的过敏反应。
因此,它并不完全清楚喷鼻剂将以及注射肾上腺素。
“我真的很讨厌学习,没有一些更好临床数据,我们推荐批准产品代理的基础上的数据不一致,虽然有些混乱,最终因为这样,患者受到损害,”委员会成员路易斯纳尔逊博士说,哥伦比亚广播公司的新闻报道。
但也不确定是否真的会更多的研究提供更多的信息。
“合理合法,我们还能期待什么?”委员会成员伦纳德Bacharier博士说。“如果这正是我们想要的,我们会有更大的信心比我们现在坐在哪里?我只是不确定。”
FDA将使其决定是否批准Neffy今年中期。该公司已表示,它可能在2023年末开始销售喷雾。药物的目的是为病人工作约66磅以上。
公司的研究包括的一项调查显示,人们可能会使用喷雾18分钟比注射药物,早,多达35%多的人会带着它。
“如果他们不拥有它,它是一个有争议的问题。他们不提供,他们没有药物,他们去医院,”Lowenthal告诉委员会,CBS新闻报道。
更多信息:美国过敏、哮喘和免疫学有更多速发型过敏反应。
版权©2023每日健康。保留所有权利。