研究指导FDA行动常见的医疗设备

身体最大的血管,腹主动脉,发送新鲜富氧的血液到身体的其他部位。在美国每年大约有200000成年人被诊断为一个腹主动脉瘤(AAA),肿胀和/或潜在的致命这至关重要的血管破裂发生在血管的墙壁削弱。年龄、高血压、吸烟等危险因素。
程序主义者可以修复主动脉瘤通过设备加强削弱主动脉支架。这种修复之前需要访问主动脉通过开放手术。近年来,血管内动脉瘤修复(腔内修复术)——的过程中折叠方法和压缩支架插入设备通过一个动脉在腹股沟,螺纹主动脉指导下x射线图像,并部署到环绕aneurysm-has成为支柱在微创手术治疗AAA。携带更少的住院风险,有助于缩短恢复时间。
然而,有限的长期数据存在评估主动脉支架的结果作为新设备设计市场。
回顾性队列研究的医疗保险受益人接受主动脉支架嫁接,史密斯结果研究中心的研究人员在贝斯以色列女执事医疗中心(BIDMC)是由美国食品和药物管理局(FDA)比较特定设备类型与我之前提到过的长期结果比较设备在市场上。
作为aaa安全的一部分Study-BIDMC-led和设计与fda安全的评估人员更新的一体式主动脉支架与其他相比,non-unibody fda批准的设备。我之前提到过
团队证明,历史和更新的一体式内未能超越non-unibody设备通过平均随访3.4年的时期。这项研究结果发表在《华尔街日报》循环支持建立一个纵向监测程序,监视主动脉支架相关的安全事件。
”建议与一体式设备相关的持续伤害与non-unibody设备相比,”Eric a . Secemsky说血管介入医学博士,硕士,主任BIDMC和aaa安全的首席研究员。“在aaa安全研究,一体式的内未能达到与非non-unibody内。我们的研究提供了一个重要的例子,如何使用真实数据来监控产品已经在市场上的安全,并帮助支持监管决策。”
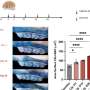
Secemsky和其同事研究数据从87163年医疗保险受益人接受主动脉支架移植超过2000美国医院在2011年和2017年之间。遵循这些病人的结果平均时间3.4年,研究人员观察了所有原因死亡率血管内支架移植后,病人是否动脉瘤破裂过程和后患者是否需要二次干预后程序。
研究小组发现,至少有一个这些条件发生在74%的一体式device-treated病人和65%的non-unibody device-treated病人。子群的病人更多的最近的过程对应于市场发布最新的一体式endograft-the端点条件的发病率是38%一体式device-treated患者中,33%在non-unibody device-treated病人。
“aaa安全分析评估一体式系统比较器设备确认安全问题与一体式内但也表明潜在的担忧与最新的迭代的设备,“Secemsky说,他也是哈佛医学院的助理教授。“因为腔内修复术已成为占主导地位的干预治疗AAA,重要的是,整个设备类我之前提到过外界密切关注不良安全事件。特别是对特定设备的设计,加强监测程序可以大大提高设备安全性的理解。”
由于aaa安全研究的结果,结合以前的研究和设备安全数据,FDA已经批准和更新设备标签,包括可能的长期风险与某些一体式腔内修复术设备有关。他们还建议医疗服务提供者考虑使用替代的腔内修复术设备时,要求厂家进行长期发布市场安全研究。
更多信息:埃里克·a·Secemsky et al,一体式的比较和Non-Unibody内腹主动脉瘤修复的医疗保险受益人:aaa安全研究中,循环(2023)。DOI: 10.1161 / CIRCULATIONAHA.122.062123