流感病毒的致命弱点:泛素蛋白可能是未来药物的一种方法
流感病毒对药物的抵抗力越来越强。因此,需要新的活性成分。Münster大学的研究人员在这方面提供了重要的发现:为了使病毒增殖,甲型流感病毒的聚合酶必须通过宿主细胞中的酶进行多次修饰。
该研究小组能够绘制出一幅全面的基因改造类型图。针对这些酶的药物将对病毒的快速突变具有弹性,因此为未来提供了巨大的潜力。研究结果现已发表在该杂志上自然通讯.
每年的流感季节都给医院带来挑战。尽管已经接种了疫苗,年纪大的人而患有健康问题更有可能患上严重的流感特别阴险的是什么流感病毒它们具有快速变异的能力,这使得它们对药物的抵抗力越来越强。因此,迫切需要新的活性成分,以便能够在未来继续为这种疾病提供有效的治疗。
Münster大学的研究人员在这个方向上迈出了重要的一步,他们提供了59个特定修改的证据聚合酶A型流感病毒,换句话说是决定性的酶负责病毒基因组副本的生产。这项研究中描述的修饰的特殊之处在于它们是由宿主细胞中的蛋白质传播的,而且与病毒蛋白质不同,它们不会迅速变异。因此,它们代表了一种有前途的生产新药的方法。
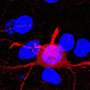
甲型流感病毒聚合酶(IAV聚合酶)是一种高度复杂的病毒蛋白质它有不止一个功能。其中之一是在结构改变后,它也可以复制病毒基因组(cRNA和vRNA)。如果没有这种功能的“切换”,病毒就无法增殖。

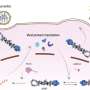
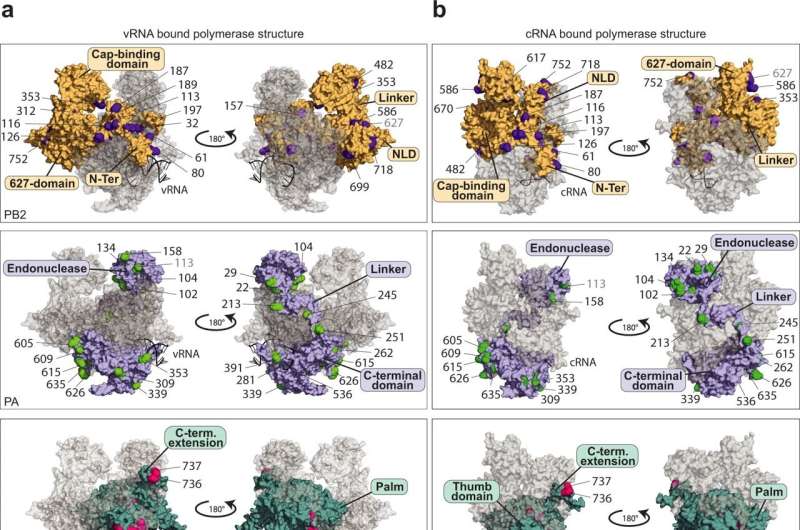
Linda Brunotte博士和Franziska博士Günl及其同事团队现在已经发现,IAV聚合酶需要来自宿主细胞的蛋白质来充当“分子开关”,并执行其不同的功能。这些蛋白质是一种酶,它将所谓的泛素蛋白停靠在聚合酶的特定位置上,从而触发功能切换的信号。
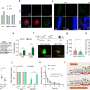
“我们能够绘制出一张地图,显示泛素通过宿主细胞附着在病毒聚合酶上的59个位置。这些都是全新的发现,揭示了甲型流感的致命弱点病毒布鲁诺特博士解释说,他领导着分子病毒学研究所的一个研究小组,也是这项研究的发起人。
这种泛素化对聚合酶17个位点的活性有一定的影响。此外,还发现了一个特定的位置,其修饰代表了聚合酶中功能转换和相关开关的信号。因此,该研究的主要作者Günl博士现在展望未来:“在我们对泛素化的映射的基础上,进一步的研究现在可以研究哪些酶具体负责IAV聚合酶的修饰。针对这些酶的药物可以抵抗突变流感病毒,因此显示出未来治疗的巨大潜力。”
更多信息:Franziska Günl等人,A型流感病毒聚合酶的泛素化景观,自然通讯(2023)。DOI: 10.1038 / s41467 - 023 - 36389 - 0