针对小鼠牛头病的药物揭示了反应的性别差异
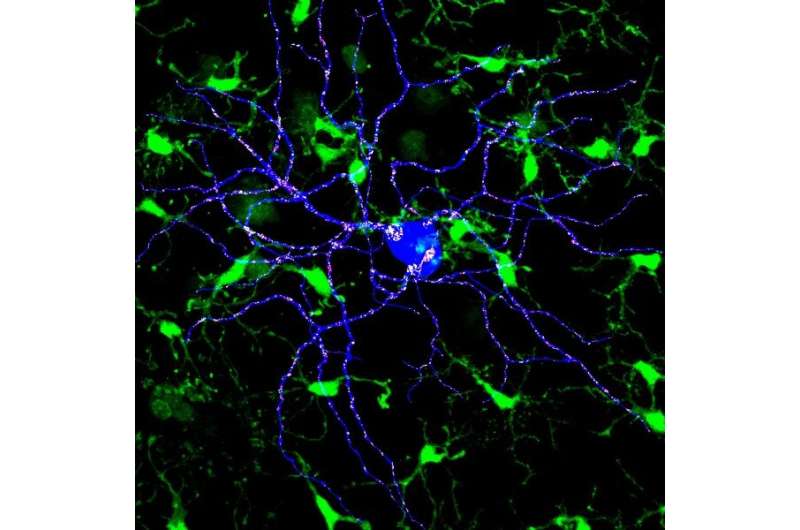
在许多神经系统疾病中,小胶质细胞对大脑健康和疾病进展都至关重要。正常情况下,小胶质细胞通过清除与痴呆症和其他脑部疾病相关的受损神经元和蛋白质斑块来稳定大脑。但越来越多的证据表明,小胶质细胞在tau病中也起着早期和持续的作用——tau病是一种神经退行性疾病,其特征是tau聚集和神经元丢失。
尽管在人类身上有明确的证据表明,某些微胶质细胞功能积极参与神经退行性疾病的进展,但确切的机制是小神经胶质细胞牛头病的功能仍不清楚。全基因组转录组研究已经确定了免疫途径,表明小胶质细胞在人类tau病和相关小鼠模型中早期和强烈参与。在小鼠中删除微胶质细胞特异性基因或遗传消融微胶质细胞是解剖疾病模型中微胶质介导机制的有用方法,但用于操纵微胶质细胞功能的药理学工具一直受到限制。
最近开发的小分子药物靶向集落刺激因子-1受体(CSF1R) -一种对中枢神经系统小胶质细胞、外周组织巨噬细胞和血液髓系细胞的生存和增殖至关重要的受体激酶,已被批准用于临床肿瘤学目的。
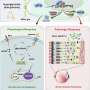
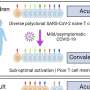
在2023年1月9日发表的一项研究中自然通讯加州大学旧金山分校神经学系和神经退行性疾病研究所的助理教授、资深作者Carlo Condello博士在年的几个时间点使用多种药物类似物系统地测试了CSF1R抑制转基因小鼠发展自发牛头病,并在诱导牛头病的接种模型。
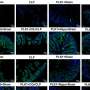
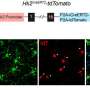
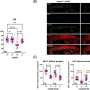
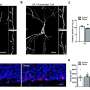
研究人员在没有完全小胶质细胞消融的情况下,在多个剂量方案中证明了tau病理的减少。药物暴露水平与tau-朊蛋白和小胶质细胞减少的程度相关,出乎意料的是,研究人员观察到神经退行性变的血浆生物标志物受到抑制,异常行为得到挽救,并延长了患者的生存期雌性老鼠.
尽管雄性小鼠暴露在更大的药物中,但只有雌性小鼠获得了功能性挽救和延长生存期。仅在雄性小鼠的大脑中观察到剂量依赖性的立即早期基因上调和神经递质失调,这表明兴奋性毒性(引起细胞损伤)可能排除了功能益处。雄性小鼠的药物弹性小胶质细胞表现出与增加的神经炎症信号一致的形态和基因表达模式,这表明性别特异性兴奋性毒性的机制基础。
Condello说:“据我所知,这是第一次证明在疗效或治疗益处上与性别相关的差异,至少在任何神经系统的适应症上都是如此。”“靶向tau沉积在雄性和雌性中同样减少,但CSF1R抑制只在雌性小鼠中延长了生存期,并挽救了其他功能缺陷,尽管雄性小鼠的药物暴露是雌性小鼠的两倍。我们发现,男性的药物消耗是一样的,但女性要活跃得多,所以我们推测,更高的新陈代谢可能在这种差异中发挥了作用。”
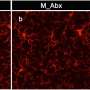
CSF1R抑制似乎优先消除雌性小鼠中的这些小胶质细胞,使大脑中的小胶质细胞更安静,炎症更少。相比之下,雄性老鼠显示药物诱导的炎性小胶质细胞表型,这可能有助于神经元兴奋毒性和治疗效果的降低。
此外,研究人员质疑使用CSF1R抑制剂进行完全或持续的小胶质细胞消融是否必要,因为这些细胞在其中发挥着重要而多样的作用大脑健康和疾病。
“我们研究的目标是确定一个治疗窗口,不仅可以减少病理标志物,还可以改善功能,”Condello说。“几乎所有其他的临床前模型都在推动药物剂量来消灭所有的小胶质细胞,实际上,将细胞视为二元的东西,所有的细胞都是坏的。相比之下,我们的研究真正指出了这样一个事实,即我们可以消融其中的一部分,仅是tau病激活的细胞,并且仍然取得治疗效果。我们的研究表明,无论是持续给药还是完全消融细胞都不是疗效和抢救所必需的。
然而,Condello指出,针对小胶质细胞的治疗必须考虑性别依赖效应。“虽然还需要进一步的调查来确定人类是否存在类似的性别依赖差异,但我们的研究可能是第一个揭示由药物干预引起的性别依赖生物学的研究,”Condello说。
更多信息:Noah R. Johnson等人,CSF1R抑制剂在tau病小鼠模型中诱导性别特异性弹性小胶质细胞表型和功能挽救,自然通讯(2023)。DOI: 10.1038 / s41467 - 022 - 35753 - w