研究人员确定可用于新型抗癌药物的癌蛋白中的神秘脆弱性
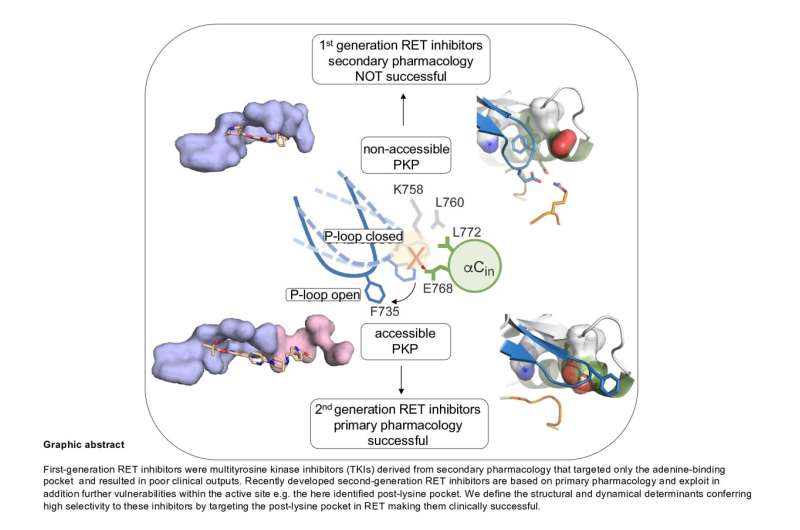
RET是一种具有酪氨酸激酶活性的受体蛋白,可以将磷酸基团从ATP转移到其他分子,从而改变其形状和功能,这对于有机体和组织维持至关重要。RET的功能遗传改变,例如产生致癌融合的点突变或染色体重排与某些类型的癌症有关,尤其是甲状腺的癌症,肺部和乳腺癌等频率较低。当前的抗癌疗法AGAISNT RET驱动的肿瘤基于RET催化活性的ATP竞争力抑制剂。第二代抑制剂,包括LoxO-292(Selpercatinib)和Blu-667(pralsetinib),已得到FDA的批准,并在癌症患者中产生了显着的临床反应。
由Ivan Plaza Menacho领导的西班牙国家癌症研究中心(CNIO)(CNIO)的激酶,蛋白质磷酸化和癌症组成功地鉴定了这些抑制剂利用的结构和动态特征,尤其是在活跃部位中的隐秘袋,该特征赋予了高度高的高度。这些化合物的特异性。“与这些抑制剂复合物中的RET催化结构域的晶体结构已经解决,但是没有确定活性位点中的隐性口袋,因为由于动态和动态和构象变化晶体结构不会捕获,”广场梅纳乔说。
激酶,蛋白质磷酸化和癌症组的重点是与癌症有关的蛋白质家族的详细结构和功能表征。这些信息可以转化为更好的化合物和抑制剂的设计,从而改善疗法。“第二代RET抑制剂最近已获得FDA批准以治疗甲状腺和肺癌,与该抑制剂结合活性站点与原型RET抑制剂相比,以异常方式。但是,我们不完全理解它们为什么如此有效。”
目前,由Plaza-Menacho领导的小组正在与CNIO的实验治疗计划密切合作,旨在识别,设计和开发针对已确定的隐性口袋和其他变构现场的新化合物。Plaza-Menacho说,我们预计其中一些热门单曲将导致可能在精确和个性化疗法中使用的药物,以治疗Ret驱动的癌症。已经描述了对这些抑制剂抗性的耐火突变。研究中的作者还为设计新药的设计提供了一些准则,这些指南可以克服这种难治性突变的影响。
该研究发表在高级研究杂志。
进一步探索