“令人窒息”的癌症:改进的黑色素瘤免疫疗法
缺氧,或组织氧合不足,是所有实体肿瘤(如黑色素瘤皮肤癌)中经常发生的情况。黑素瘤细胞不仅能在缺氧条件下存活,而且还能通过劫持抗肿瘤免疫反应和发展对传统抗癌疗法的抵抗机制来利用缺氧对自己有利。负责癌细胞适应缺氧的关键基因是HIF-1α(缺氧诱导因子-1α)。
由卢森堡卫生研究所(LIH)肿瘤免疫治疗和微环境(TIME)研究组的负责人Bassam Janji博士领导,并与法国Gustave Roussy癌症中心和阿拉伯联合酋长国海湾医科大学Thumbay精确医学研究所合作,该团队使用基因编辑技术展示了靶向HIF-1α不仅可以抑制肿瘤生长,而且可以驱动细胞毒性(对细胞有毒)。免疫细胞癌症组织。这一发现提供了一个有价值的新靶点,使耐药黑色素瘤更容易受到现有抗癌治疗的影响。他们的研究结果最近发表在著名的致癌基因日报》。
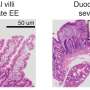
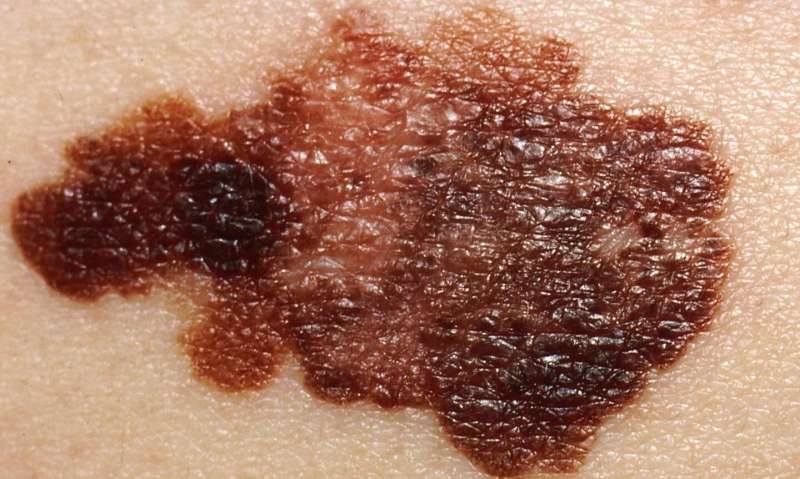
黑色素瘤是一种皮肤癌,由负责产生色素的黑色素细胞发展而来。如果不及早发现,黑素瘤将更难治疗,而出现的治疗耐药性是其有效治疗的一个重要障碍。由于其生长速度快,血供不足,实体瘤包括黑素瘤经常出现缺氧区域。缺氧,或肿瘤微环境中氧气的减少,通常会导致肿瘤细胞死亡。
“然而,某些实体肿瘤已经进化到通过激活HIF-1α来在这种不利的微环境中生存,据报道,HIF-1α基因是调节组织氧水平变化的适应性反应的主要因素,”Janji博士解释道。小威廉·g·卡林、彼得·j·拉特克利夫爵士和格雷格·l·塞门扎因发现HIF-1α以及细胞如何利用它感知缺氧而被授予2019年诺贝尔生理学或医学奖。据报道,低氧也会导致肿瘤对传统抗癌疗法的反应失败,并会阻止免疫细胞浸润到肿瘤中。因此,了解癌细胞是如何克服这种缺氧环境来提高现有抗癌疗法的有效性是至关重要的。
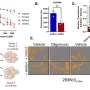
在这种背景下,Janji博士领导的团队试图使用CRISPR基因编辑技术使HIF-1α基因的功能失活,并在临床前黑色素瘤小鼠模型中研究这种失活对肿瘤生长、免疫细胞浸润和免疫治疗反应的影响。
“我们的研究表明,阻断HIF-1α的活性显著抑制了黑色素瘤的生长,并通过增加CCL5的释放,放大了免疫细胞对肿瘤微环境的渗透,CCL5是一种明确的介质,参与驱动细胞毒性免疫细胞到肿瘤战场,”该出版物的第一作者Audrey Lequeux博士总结道。重要的是,该研究还表明,联合使用一种旨在阻止缺氧的药物可以显著改善黑色素瘤的免疫治疗。
当对473名黑色素瘤患者的队列进行回顾性验证时,肿瘤的缺氧特征与恶化的结果和缺乏免疫细胞浸润肿瘤相关,这被认为是肿瘤对免疫疗法的抵抗的主要特征。
“总之,我们的数据有力地表明,破坏HIF-1α的治疗策略将能够调节肿瘤微环境,允许免疫浸润细胞.海湾医科大学的Chouaib博士和卢森堡卫生研究所的Janji博士分别得出结论说:“这种策略可以用于改善无反应黑色素瘤患者的基于疫苗和基于免疫检查点阻断的癌症免疫疗法。”