有效的癌症免疫疗法进一步与调节细胞“自杀”基因有关

约翰·霍普金斯(Johns Hopkins)医学研究人员补充了证据,表明负责关闭细胞自然“自杀”信号的基因也可能是使乳腺癌和黑色素瘤细胞耐药地使用免疫系统抗癌的疗法的罪魁祸首。该研究的摘要是由小鼠和人类细胞进行的,于8月25日出现在细胞报告。
当该基因(称为Birc2)被发送到超速驱动器中时,它产生了太多或“过表达”蛋白质水平。这发生在大约40%的乳腺癌中,尤其是称为三重阴性的更致命的类型,并且尚不清楚该基因在黑色素瘤中过表达多久。
研究人员说,如果进一步的研究确认并完善了新发现,BIRC2过表达可能是一个关键标志免疫疗法抗性,进一步推进了癌症治疗领域的精确医学工作。这种标志可能会提醒临床医生可能需要使用阻断基因活性与免疫疗法药物结合使用的药物,形成一种有效的鸡尾酒,以杀死某些耐药患者的癌症。”癌症。细胞使用许多途径逃避免疫系统,因此我们的目标是在我们的工具箱中找到其他药物,以补充目前正在使用的免疫疗法药物。,约ob体育开户网址翰·霍普金斯大学医学院的儿科,肿瘤学,医学,放射肿瘤学和生物化学,以及约翰·霍普金斯细胞工程研究所的血管计划主任。
Semenza分享了2019年诺贝尔生理学或医学奖,用于发现该基因,该基因指导细胞如何适应低氧水平,这种疾病称为缺氧。
2018年,Semenza的团队表明,缺氧基本上将癌细胞塑造成生存机。缺氧促使癌细胞通过灭活识别系统或对免疫细胞的“吃我”信号来帮助它们逃避免疫系统。一种称为CD47的细胞表面蛋白是唯一的“不要吃我”的信号,该信号通过称为巨噬细胞的免疫细胞杀死癌细胞。其他细胞表面蛋白PDL1和CD73,被称为T淋巴细胞的免疫细胞杀死癌细胞。
这些超级活癌细胞可以部分解释Semenza说,为什么只有20%至30%的癌症患者对增强免疫系统靶向癌细胞能力的药物有反应。
对于当前的研究,基于他的基础科学发现,Semenza和他的团队通过波士顿Dana Farber癌症研究所确定的325个人类基因分类,其蛋白质产物在黑色素瘤细胞中过表达,并与帮助癌细胞逃避的过程有关免疫系统。
Semenza的小组发现,38个基因受转录因子HIF-1的影响,该基因调节细胞如何适应缺氧。在38中,有BIRC2(杆状病毒IAP重复含2),已经众所周知,可以防止细胞“自杀”或凋亡,本质上是一种程序性细胞死亡的形式,是对癌症的不受控制的细胞生长特征的制动器。
BIRC2还阻止细胞分泌吸引免疫细胞的蛋白质,例如T细胞和天然杀伤细胞。
首先,通过研究人类的BIRC2基因组乳腺癌Semenza的小组细胞发现,低氧蛋白HIF1和HIF2在低氧气条件下直接与BIRC2基因的一部分结合,从而确定了增强BIRC2基因产生的直接机制。
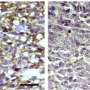
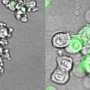
然后,研究小组检查了小鼠在注射人类乳腺癌或黑色素瘤细胞的基因工程中,几乎没有BIRC2基因表达时如何发育。在注射缺乏BIRC2表达的癌细胞的小鼠中,与在小鼠中形成肿瘤所花费的典型两周相比,肿瘤花费了更长的时间,大约三到四个星期。
由BIRC2无的癌细胞形成的肿瘤还具有称为CXCL9的蛋白质水平的五倍,该蛋白质吸引了免疫系统T细胞和天然杀伤细胞到肿瘤位置。肿瘤形成的时间越长,在肿瘤内发现了越多的T细胞和天然杀伤细胞。
Semenza指出,在肿瘤中发现大量免疫细胞是免疫疗法成功的关键指标。
接下来,为了确定免疫系统是否对他们看到的失速肿瘤生长至关重要,Semenza的团队注射了Birc2无黑色素瘤和乳房癌细胞饲养的小鼠没有功能免疫系统。他们发现,肿瘤在大约两周内与典型肿瘤相同。Semenza说:“这表明与BIRC2丢失相关的肿瘤生长率降低取决于将T细胞和天然杀伤细胞募集到肿瘤中。”
最后,Semenza和他的团队分析了植入人类乳房的小鼠癌症或产生BIRC2或设计为缺乏BIRC2的黑色素瘤肿瘤。他们给小鼠患有黑色素瘤肿瘤两种类型的免疫疗法FDA批准用于人类使用,并用一种免疫疗法药物治疗了乳腺肿瘤的小鼠。同时瘤类型,免疫疗法药物仅对缺乏BIRC2的肿瘤有效。
目前,针对某些类型的癌症的临床试验正在进行临床试验,但Semenza说,这些药物在自身使用时并不是很有效,但目前正在临床试验中,称为smac Mimetics的实验药物正在临床试验中。
Semenza说:“这些药物对于改善BIRC2水平较高的肿瘤患者的免疫疗法药物的反应可能非常有用。”
进一步探索












用户评论