给Nova-Lamperti博士;康赛普西翁(智利大学从毛埃尔南德斯,MSc和Elard科赫教授,博士,从丽萨研究所。信贷:梅丽莎研究所
领导的合作研究免疫学家给Nova-Lamperti康赛普西翁(智利)的大学,与丽萨研究所的研究人员的一个分支和其他国际学术中心,取得进展的分子机制的了解预防口腔癌的一种有效的抗肿瘤免疫反应;后者由于生产的化学介质,从而诱导抗炎监管回应,有利于肿瘤发展通过维生素D信号通路。该研究发表在免疫学前沿2021年5月7日。
口腔癌,其中90%对应于鳞状细胞类型,是肿瘤死亡率和发病率高,主要是因为诊断在晚期转移已经存在,而治疗产生严重的生理和功能续集幸存者之一。
众所周知,免疫系统在癌症的发展中扮演着重要角色,通过刺激途径发挥抗肿瘤角色,或者相反,通过生成抗炎环境允许肿瘤生长和扩散。
的主要生物制剂免疫系统淋巴细胞或T细胞,有不同的功能和表型。癌症,调节性T细胞亚群)和辅助T细胞2型(Th2)与预后差相关,而辅助T细胞的反应1型(Th1)在肿瘤,一般来说,展示一个更好的预后。
Nova-Lamperti博士指出,一个关键问题口腔癌就是抗炎微环境的诱导,促进肿瘤的生长。到目前为止,“与这相关的免疫调节机制的变化免疫反应是未知的,它并不承认他们是否来自外部的肿瘤,”解释了免疫学家。
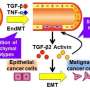
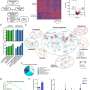
使用流式细胞仪技术,研究小组能够15 t细胞表型在活检主要特性的口腔癌患者并与16活检无病中的t细胞的数量控制。因此,他们发现了一个主要的分布表达CCR8 + T细胞受体(通常在皮肤组织丰富),Th2-like调节性T细胞,和一个小的人口Th1细胞。
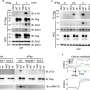
基于这些新发现,研究人员推测,肿瘤微环境从活检获得文化的口腔癌患者,其中包含由肿瘤细胞分泌的因素检查参与组成分泌腺(称为),有能力诱导抗炎表型本身。为了验证这个假设,Nova-Lamperti和她的同事们挑战与检查参与组成分泌腺肿瘤免疫T细胞亚群,利用基因组学和蛋白质组学技术,确定如何mRNA转录和蛋白质表达的这些细胞被修改。
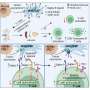
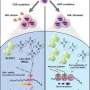
值得注意的是,转录组显示,检查参与组成分泌腺口腔癌诱导表达的一组基因控制维生素D (VitD)信号通路在T细胞。此外,蛋白质组学研究中,通过高分辨率质谱分析,揭示了存在的几个相关的蛋白质的生产前列腺素E2 (PGE2)与VitD快速信号在细胞膜。此外,研究人员发现减少蛋白质携带VitD进入细胞。
基于这些发现,研究人员建议,减少VitD的流动促进肿瘤微环境的浓度的增加,诱导抗炎表型的肿瘤。在新的实验中,研究人员质疑t细胞文化VitD和PEG2确认VitD诱发CCR8 Th2监管响应表达式,而VitD和PEG2抑制小蛋白质称为细胞因子的生产。后者是重要的激活免疫系统。此外,研究表明,结合CCR8受体的细胞因子,趋化因子CCL18,在肿瘤中,支持一个恶性的循环,它刺激亚群细胞在肿瘤微环境“停滞不前”。
对免疫学家研究的影响,指出,“结果就会有趣的生物疗法的发展集中在抗体能够阻止特定分子,有利于肿瘤生长的作用。例如,在口腔中癌症治疗,有选择地块CCR8受体或规范化维生素D的信号通路可能最终减缓肿瘤的生长,减少外科切除术的续集,改善这些患者的生存。”The researcher stressed the need to continue doing research in this regard.
质谱专家研究毛埃尔南德斯丽萨研究所称,“合作在这个研究是具有挑战性;的蛋白质组学研究需要一些耗时的程序来获得最优结果。例如,因为我们处理的细胞培养基,每个样品必须耗尽“盾牌”的丰富的蛋白质如白蛋白或很难检测更小、更少的丰富的蛋白质;然后我们进行离线分馏来增加我们的识别能力。这包括一个色谱法的步骤细分每个样本,这大大增加运行在我们的质谱仪和数量的增加在随后的生物信息学分析。”
最后,Elard科赫教授,丽萨研究所高级研究员兼董事长,说他们很高兴被邀请参加由Nova-Lamperti博士领导的研究;“与我们合作多组学能力相关研究的这一个是鼓励我们研究所的研究人员和一个关键目标“科赫说。
更多信息:马可·弗拉加et al,辅助T细胞的免疫调节肿瘤微环境在口腔癌与CCR8表达式和快速膜维生素D信号通路,免疫学前沿(2021)。DOI: 10.3389 / fimmu.2021.643298
期刊信息:免疫学前沿
梅丽莎研究所提供的