新方法在单分子尺度上演示了药物如何与阿尔茨海默氏症多肽聚集物相互作用
了解某些化学品如何与我们体内的分子过程相互作用是发展有效药物的关键。这对于复杂的神经变性疾病肯定是真实的,例如Alzheimer和Parkinson的,没有有效的治疗可以获得。来自Wageningen大学和剑桥大学的科学家来了一步。他们设法研究 - 在分子水平 - 在阿尔茨海默病发放中涉及的FDA批准的药物和蛋白质聚集体之间的相互作用。他们的结果发表在自然通讯。
“阿尔茨海默病的疾病的发病与患者大脑中叫淀粉样蛋白β的蛋白肽的肽聚集在一起,”韦比宁大学有机化学和物理化学助理教授弗朗切斯科西蒙斯·拉吉尔斯(Rentant)教授。“在过去的二十年中,大量努力致力于制定可能干扰这种聚集的化合物。然而,我们仍然没有用于临床使用的药物。其中一个主要原因是我们并不完全理解如何毒品和毒品小分子与参与细胞毒性的特定淀粉样物质相互作用。”
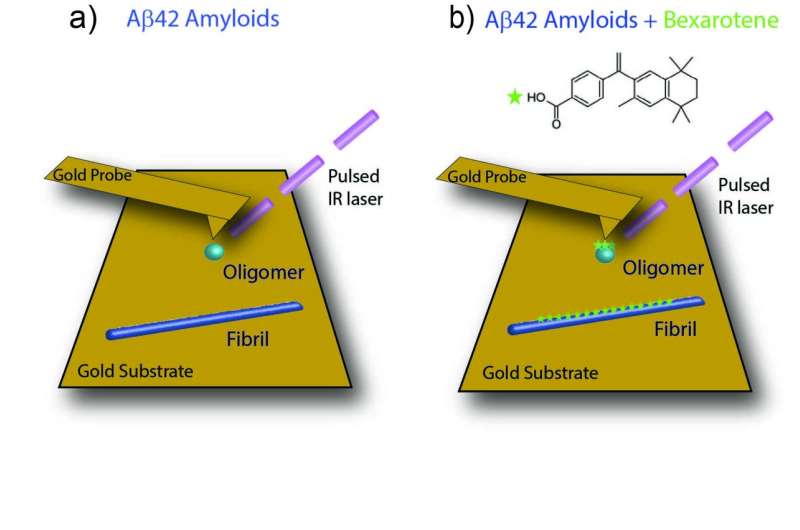
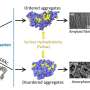
Ruggeri和他的剑桥同事们采用了一种新的方法来解释这些相互作用。他们的总和原子力显微镜-一种先进的成像技术,允许在纳米尺度上研究单分子红外光谱法,阐明了生物分子的化学性质。它们的组合称为红外纳米谱检测,提供了两种世界的最佳,允许在纳米级上进行化学和结构表征。
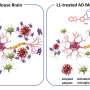
科学家们使用这种方法来研究小分子苯甲酯的淀粉样蛋白β肽的聚集体如何与阿尔茨海默蛋白β肽的聚集体相互作用。“在早期的研究中,我的剑桥同事已经证明是贝卡罗琳在体外造成聚集,并逆转其在阿尔茨海默病的细胞和动物模型中的神经毒性,”Ruggeri说。“去年,我能够表明这种联合的红外纳米光谱技术可以达到单分子敏感性。现在是时候结合了这两个结果。这是第一次使用这种方法研究任何药物目标互动单一分子水平。直到现在,这是研究药物如何作用于这些肽聚集体的限制因素。“
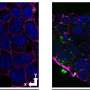
结果证明,贝卡罗宁分子的特定部分 - 其羰基 - 通过单一氢键对其与聚集体相互作用。“这是对药物目的有用的这种信息,”Ruggeri解释道。“如果您知道分子的哪个部分负责其化学活动,您可以寻找优化化合物的方法,并开发成功的药物方法来延迟或治愈神经变性障碍。”
蛋白质聚集物,例如阿尔茨海默氏症中的那些,在本质上是非常不均一的和短暂的。一些错误折叠聚集的物种是有毒的,而另一些可能是保护性的。“因此,我们希望药物只针对特定的物种或途径,”这位化学科学家强调说。“任何药物方法都应该以优化功能为目标。要做到这一点,您需要了解它是如何工作的,这是分子以及什么能帮助或拖延他们的行动。”
这就是为什么这种新方法如此有用,因为文章自然通讯结束。它不允许研究贝卡罗琳的工作,但是任何化合物。因此,这项研究开辟了一种新的范例来进行单分子药物发现。Ruggeri:“我的同事在商店里有几个其他有前途的。我们现在有一个工具可以详细研究所有这些工具。”










用户评论