新型技术聚光灯在阿尔茨海默病中淀粉样蛋白β的神经元摄取
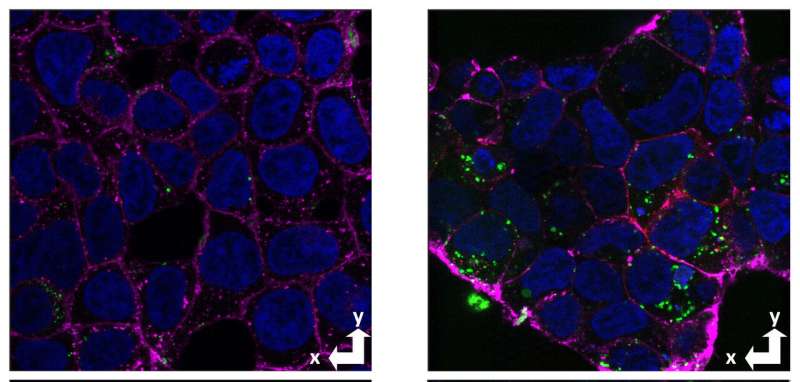
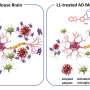
阿尔茨海默病的标志之一是形成蛋白质的淀粉样蛋白斑块 - 粘性蛋白质,称为淀粉样蛋白β-聚集在脑中的神经元之间。然而,越来越多地注意这些不溶的斑块与可溶性形式的淀粉样蛋白β可溶于神经元并且是高度神经毒性的。
加利福尼亚大学圣克鲁斯大学研究人员的一项新研究,确定了一系列淀粉样蛋白β蛋白质这被参与神经元摄取这种有毒肽的受体所识别。研究人员使用了一种新的方法来研究细胞摄取的机制淀粉片β。他们的研究结果于11月2日发表在国家科学院的诉讼程序的研究表明,针对这一过程可能是开发阿尔茨海默病药物的一种有前途的方法。
“在细胞内淀粉样蛋白有毒的方式有很多,所以如果我们能阻止神经元对它的吸收不是很好吗?”这是我们可以瞄准的一个途径,”通讯作者Jevgenij Raskatov说,他是加州大学圣克鲁兹分校的化学和生物化学助理教授。
在这项新的研究中,Raskatov与UCSC杰出的化学和生物化学教授Glenn Millhauser合作,研究了β淀粉样蛋白与细胞朊蛋白的相互作用。米尔豪泽的实验室研究了朊病毒的结构和功能,朊病毒是一种存在于各种细胞表面的膜蛋白,包括大脑中的神经元。
以前的其他研究人员的研究表明,正常的细胞朊病毒蛋白(不是导致的异常变体朊病毒疾病)与淀粉样蛋白β块结合并参与摄取和神经毒性。由研究生Alejandro Foley和Proddoctoral研究员Graham Roseman领导的UCSC研究人员试图测试朊病毒蛋白是否也充当可溶性形式的淀粉样蛋白β的受体,并鉴定与该受体结合的淀粉样蛋白β内的位点。
研究人员采用了一种方法,根据raskatov的实验室使用镜子图像版本的淀粉样蛋白β的实验室,表明细胞摄取大部分由细胞表面上的受体介导。在早期的工作中,研究人员将天然淀粉样蛋白β的吸收与合成版本进行了比较,其中原子在蛋白质中的排列氨基酸是自然排列的镜像。这种重新排列微妙地改变了蛋白质的结构,从而干扰了它与受体的结合,因此发现细胞对镜像版本的摄取大大减少,表明这是受体介导的摄取。
淀粉样蛋白β可以是不同的长度,但最有毒的变体是42个氨基酸长。为了将参与受体结合所涉及的部位,研究人员创造了由例如氨基酸1至16或1至30组成的淀粉样蛋白β的肽段文库。对于每个部分,它们用天然氨基酸制成了一个版本(“L立体异构体”)和镜像氨基酸(“D立体异构体”)。
在测试文库中的所有肽进行蜂窝摄取后,他们发现氨基酸1-30显示出与全长淀粉样蛋白β相同的立体选择性,其具有比D形式更大的L形式的摄取。此外,该细分是完全可溶的,并且不形成聚集体,因为它缺少蛋白ββ聚集成块和原纤维的长疏水结构域。
拉斯卡托夫说:“有了这种缩短的β淀粉样蛋白,我们能够将细胞摄取与聚集分离开来,这为我们研究摄取提供了一个很好的模型。”
通过评估具有和没有朊病毒蛋白质的细胞中的淀粉样蛋白β摄取,研究人员首次证明了朊病毒蛋白在可溶性淀粉样蛋白β的细胞吸收中的作用,与其对淀粉样蛋白β的L立体异构体的选择性一致。
非聚集的β -淀粉样蛋白片段1-30表现出相同的朊病毒依赖摄取和立体选择性。研究人员还使用核磁共振波谱技术来收集有关β淀粉样蛋白与细胞朊病毒结合过程中相互作用的详细信息。
他们的研究结果表明,β淀粉样蛋白在细胞表面的结合,导致其内化,主要是由于氨基酸序列1-30,而不是聚集状态。当淀粉样蛋白分子开始聚集时,它们形成了“低聚体”,由少量粘在一起的分子组成,这些分子仍然是可溶性的,可以被神经元吸收。这些可溶性寡聚体越来越被认为是引发阿尔茨海默病的病理过程的β淀粉样蛋白的形式,但也有许多不同的聚合形式。
“有不同程度的聚集,不同的尺寸和低聚物类型,并且大问题已被内化并导致神经毒性,”莱斯图夫说。“我们的研究结果表明,氨基酸序列暴露的任何形式将与朊病毒蛋白结合。”
根据Millhauser的说法,“导致阿尔茨海默病的初始步骤可以是朊病毒蛋白介导的可溶性淀粉样蛋白β进入神经元的朊病毒蛋白介导的转运,然后在其上丛丛,形成有毒聚集体,最终导致与疾病相关的特征斑块。”
虽然朊病毒蛋白质似乎负责大部分淀粉样蛋白的摄取,研究表明其他受体可能提供替代的途径。然而,靶向淀粉样蛋白1-30片段或其与受体结合的位点的药物可能具有治疗阿尔茨海默病的潜力。
“我们的调查结果开辟了了解Alzheimer的新途径,并提出了有希望的治疗方法策略,”Millhauser说。
进一步探索












用户评论