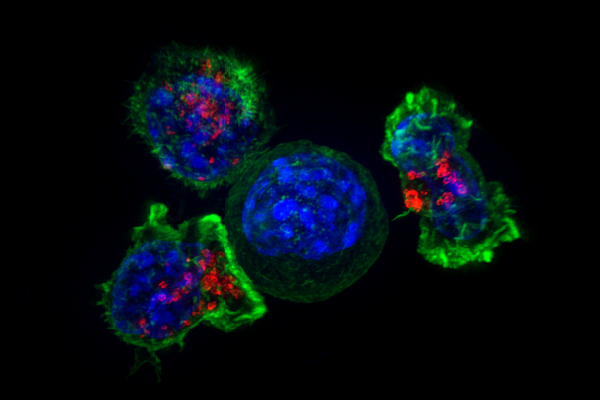
杀手T细胞围绕癌细胞。信用:NIH.
治疗肿瘤是一个棘手的难题:更高剂量的辐射对治疗更有效,但剂量越高,它对健康细胞造成的危险就越大。
耶鲁大学(Yale)的研究人员在一篇题为《LRRC31抑制DNA修复并致敏》(LRRC31抑制DNA修复并致敏》(LRRC31抑制DNA修复并致敏)的论文中取得了重大进展乳腺癌脑转移放射治疗,“ 出版于自然细胞生物学2020年10月1日。首席调查员江苏博士周,博士神经外科副教授生物医学工程在耶鲁医学院和他的团队中,描述了该研究的独特发现:拟有的纳米粒子载有可能使乳腺癌脑转移的基因(脑部肿瘤来源于乳腺癌)更敏感辐射治疗。他们报告说,该程序显著提高了荷瘤小鼠在接受放射治疗后的存活率。
乳腺癌脑转移(BCBM)发生在10 - 15%的4期乳腺癌患者中,5年生存率为22%。放射治疗是BCBM的标准治疗方法但放射剂量足够安全足以杀死癌细胞是一个微妙的平衡。这是因为大多数单元格中的固有机制导致它们开始修复过程一旦用辐射击中。因此,足够高的辐射剂量以完全破坏癌细胞并需要保持其修复本身,但这意味着也威胁健康的细胞。
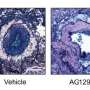
减少所需辐射量的一种方法是找到减速或停止肿瘤细胞的修复机制而不影响健康细胞的方法。为此,周的团队博士将基因编辑技术CRISPR在称为含亮氨酸的重复蛋白31(LRRC31)的基因上为零。该蛋白质结果是这些类型的癌细胞的最有效的无线电敏化基因。
一旦LRRC31基因被识别出来,研究人员就面临着将其转移到脑部肿瘤部位的挑战。这是因为血脑屏障(BBB)阻止潜在的危险物质,包括用于化疗的药物,从血液进入大脑。虽然转移性肿瘤部分破坏血脑屏障,但血脑屏障仍然完整,足以阻碍大多数治疗。
“对大脑的药物递送非常困难,”周博士说。“我们使用纳米粒子,被设计为将血脑屏障的血脑屏障递过靶向肿瘤。”这些LRRC31负载纳米颗粒由他的实验室开发,并且由于转移而利用BBB的泄露,以进入肿瘤部位。
在他们的研究中,人类BCBM细胞被移植到小鼠体内,然后用纳米颗粒治疗小鼠。然而,最终的目标是开发出能够成功用于人类的治疗方法。然而,“转化为临床治疗(对人类)总是需要很长的时间,”周博士说。“如何加强放射治疗是一个显而易见的问题,我们正在研究这个问题,但就DNA修复而言,它在许多其他治疗方案中都扮演着重要角色,比如免疫疗法或基因组编辑。”
更多信息:Yanke Chen等人。LRRC31抑制DNA修复并敏感乳腺癌脑转移到放射治疗,自然细胞生物学(2020)。DOI:10.1038 / S41556-020-00586-6
期刊信息:自然细胞生物学
由...提供耶鲁大学