专家敦促FDA允许使用非处方助听器

Mass Eye and Ear的听力损失专家正在呼吁美国食品和药物管理局(FDA)实施国会通过的一项法律,允许销售非处方药助听器。
在11月19日公布的新列中新英格兰医学杂志,专家们写道,在错过了实施2017年非处方助听器法案的法定截止日期后,FDA一直保持沉默。作者指出,助听器通常不在保险范围内,这样的新规定可以大大增加人们使用助听器的机会,并改善3000万听力障碍的美国人的生活质量。
“作为医疗提供者,我们充分欣赏了Covid-19大流行对医疗保健所有部门的影响。然而,对于OTC助听器的无所作为正在离开数百万美国人而没有得到必要的设备,并将通过实施中受益。在本法中,凯文·弗兰克,博士,大众眼睛和耳朵听力学主任以及哈佛医学院耳鼻喉科和颈部手术部的教师成员。“我们呼吁FDA制作OTC助听器的优先事项为美国人民并解决自以来的震耳欲聋沉默联邦政府听到来自倡导者的呼吁,并在三年前发布了立法任务。“
自2017年通过以来,国会法律一直停滞不前
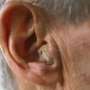
听力障碍会显著影响一个人的生活质量。许多研究都报道了助听器的好处;然而,据估计只有15%到30%符合条件的听力损失患者得到了助听器。这可能是由于对听力服务的访问有限,并且昂贵的价格听力助剂每只耳朵的价格超过2,300美元,并且通常不被保险覆盖。
这些障碍促使国会通过了2017年的跨党派非处方助听器法案,该法案要求FDA在三年内对治疗轻度至中度听力障碍的成人使用非处方助听器提出监管建议。FDA错过了2020年8月18日发布备受期待的法规的最后期限,理由是COVID-19大流行期间存在相互竞争的优先事项。然而,由于在大流行期间要求戴口罩和呼吁保持社交距离对听力受损者及其唇读能力产生了负面影响,作者认为,现在对非处方助听器的需求比以往任何时候都要大。
作者提供了监管的建议
在该法案的要求中,国会要求FDA制定法规,以确保OTC助听器的安全性和有效性。然而,大多数通过诊所销售的助听器都不受FDA上市前审查的限制,而且制造商不需要提交其安全性和有效性的证据才能获准上市。目前这种框架的缺乏将评估助听器性能的责任推给了患者和他们的助听器提供者。
“我们认为,FDA需要预先令的测试将是至关重要的,因此任何患者在线商店或亲自购买助听器的患者会收到一项被证明是有效的产品,”博士后临床医学博士临床大众眼睛和耳朵的人。“目前的助听器市场非常巩固,但创造一类过度柜台的助听器可以鼓励新的制造商进入并促进创新。所说,较新并不总是更好。监管机构和临床医生需要仔细评估新技术他们上网时。“
作者表明FDA可能需要对新型OTC助听器或新模型的临床研究,用户界面与先前批准的设备大大不同。他们还要求研究评估用户拟合艾滋病辅助艾滋病或其他OTC助听器的比较有效性。此证据可以帮助支持知情的决策,因为患者和临床医生适应可用设备的显着增加。
建立更严格的上市前要求可以帮助FDA更清楚地区分听力有辅助和其他可穿戴的声音放大产品可在线获得。作者敦促FDA严格执行这些类型的设备之间的区别,并与联邦贸易委员会(FTC)合作,以防止消费者的混淆,特别是当这两种类型的设备可在同一销售点提供时。
进一步探索










用户评论