CLCN6被鉴定为一种严重的溶酶体神经退行性疾病的疾病基因
CLCN6基因的突变与一种新的、特别严重的神经退行性疾病有关。来自莱布尼兹- forschungsinstitut für Molekulare Pharmakologie (FMP)和Max Delbrück Center für Molekulare Medizin (MDC)的科学家们,连同一个国际研究团队,现在分析了在三个不相关的受感染儿童中发现的点突变的影响。ClC-6是氯离子通道和氯离子/质子交换体的CLCN基因家族的9个成员之一,除了ClC-3,是唯一一个尚未与任何人类疾病相关的基因。研究结果刚刚发表在美国人类遗传学杂志。
术语“溶酶体储存疾病“总结了许多因溶酶体功能不正确或不足而导致的遗传确定的代谢疾病。这些细胞细胞器既具有”细胞废物处理“和细胞代谢的调节也很重要。如果溶酶体功能受到损害,通常会的物质降解可能在受影响的细胞中积累。这可能会损害它们的功能,最终可能导致细胞死亡。在中枢神经系统中,这经常受到影响,因为成年神经元无法再生,这可能导致神经变性。
Researchers from the Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) and the Max-Delbrück-Centrum für Molekulare Medizin (MDC), in close collaboration with colleagues from Rome, Hamburg and the U.S., have now found and characterized the gene defect underlying a novel severe form of neurodegenerative疾病三名来自意大利、德国和美国的儿童的CLCN6基因发生突变,导致严重的发育迟缓、智力残疾、严重影响肌肉张力的张力减退、呼吸功能不全、视力障碍和早发性脑萎缩。
离子转运体ClC-6是氯离子通道家族的一员
人类遗传学家,包括来自罗马的马可·塔尔塔利亚(Marco Tartaglia)和来自汉堡的克斯汀·库切(Kerstin Kutsche),在他们的基因组中分别发现了同样的点突变年轻患者并请Thomas Jentsch教授及其团队研究该突变对ClC-6转运特性及其细胞功能的可能影响。Jentsch是CLC氯离子通道家族的发现者,他已经在几乎所有9个CLC基因中发现或确定了不同的致病突变。这些都与一系列不同的病理有关。只有编码离子转运蛋白ClC-3和ClC-6的基因尚未被发现发生突变人类疾病。“大约十五年前,我们已经产生了CLC-6淘汰赛鼠标,发现它显示出轻度神经元溶酶体储存。但是,我们对CLC-6中的类似损失功能突变的患者进行了不成功,”Jentsch教授解释道。“现在我们已经确定了一种更严重的人类疾病的不同类型的CLC-6突变。”
在显示相同疾病模式的三个独立患者中存在完全相同的突变已经表明了突变的因果作用。但只有这一点功能分析在细胞培养带来了最终的确定性,并导致分类为溶酶体疾病。“我们的细胞培养实验清楚地表明,由突变的ClC-6增加的离子转运会影响溶酶体,从而证明了突变的有害影响。基于这些结果,并考虑到我们以前的小鼠模型,我们假设这种新疾病可以归类为溶酶体存储病,”Thomas Jentsch解释说。然而,这种分类的明确证据需要病人的脑切片或携带相同突变的新老鼠模型的死后检查。
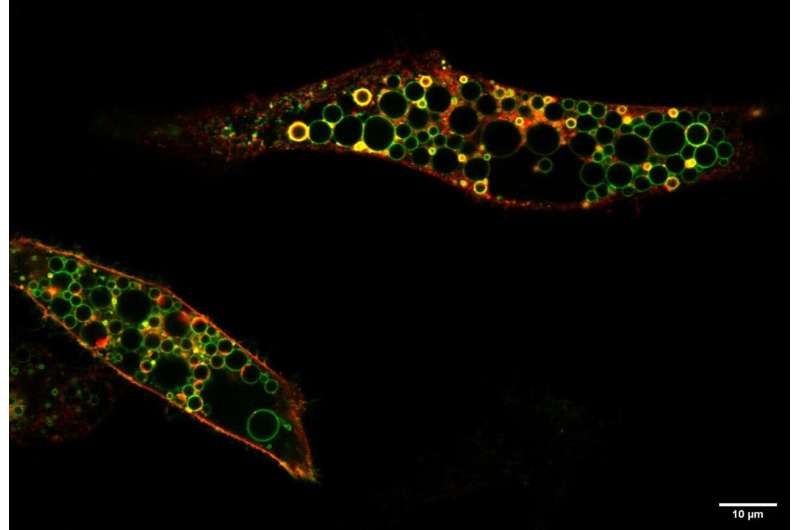
更多氯化物摄取导致异常大,溶酶体样囊泡
与氯离子通道ClC-1、-2、-3和-K不同,氯离子/质子交换体ClC-3、-4、-5、-6和-7不是位于质膜上,而是位于胞内膜上,主要位于核内体和溶酶体上。在之前的研究中,Jentsch和同事确定ClC-7突变是一种与骨质硬化相关的溶酶体储存疾病的原因,而ClC-4突变导致智力缺陷。虽然ClC-7在溶酶体上被发现,但ClC-6主要位于晚期内吞体,一种溶酶体前体。
柏林的研究小组发现,患者的突变导致了ClC-6的过度活跃,这与之前的敲除小鼠模型中ClC-6的缺失形成了对比:氯离子和质子的运输大大增加,不再受pH值的调节。通常呈酸性的pH值,在从核内体到溶酶体的过渡过程中逐渐达到,抑制了转运体。这种调控在致病突变体中缺失。增加的、不受调节的离子转运——一种功能的病理增加——导致细胞中巨大的溶酶体样囊泡,这些囊泡是用来产生突变的ClC-6的。Jentsch认为,这种功能的病理增加可以解释儿童疾病。
“膜中携带突变ClC-6的囊泡因氯化物的摄取增加而病理增大,随后是水。这种摄取是由clc -6介导的质子交换驱动的,这些质子大量存在于囊泡的酸性内部。这严重损害了溶酶体的功能,从长远来看,可能导致溶酶体储存在神经元中,使细胞无法增殖。ClC-6的组织分布,几乎只在神经元中发现,导致了主要的神经系统疾病。”
Jentsch说:“目前的工作强调了离子转运对于内切-溶酶体途径的重要性。”“我们看到很多遗传性疾病都是由囊泡性CLCs或不同细胞内通道的突变引起的。”不同的器官会受到影响:例如,突变在内体CLC-5导致肾结石和蛋白质损失进入尿液,因为Jentsch的团队很久以前展示了。
Jentsch相信,CLC-3交换器也很快将与遗传疾病联系起来 - 先前由本集团发表的KO老鼠显示出戏剧性神经变性。与目前的发现一起,这将将所有9种CLCN基因联系起来对人类遗传疾病。“差距是关闭”,“杰文奇说:”我们可以非常清楚地看到基础研究的重要程度 - 我们已经克隆了来自电鱼的第一个CLC - 是为了诊断和理解人类疾病。“
进一步探索













用户评论