新方法揭示了帕金森病蛋白质破坏细胞膜
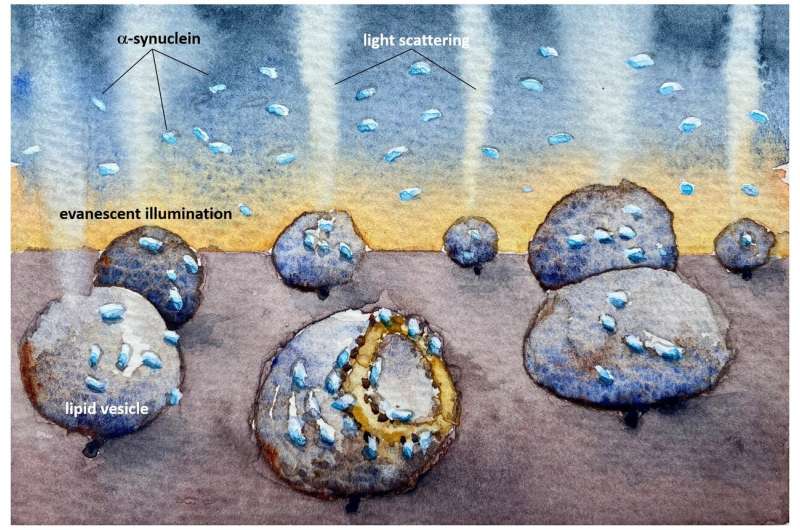
帕金森症患者有团α-synuclein(α-突触核蛋白),有时被称为“帕金森蛋白质,发现在大脑中。这些破坏细胞膜,最终导致细胞死亡。现在,开发的一种方法,查尔姆斯理工大学的瑞典,揭示了细胞膜的组成似乎是一个决定性的因素有少量α-synuclein造成损害。
帕金森病是一种无法治愈的,患者的神经元,大脑的神经细胞,逐步分解和大脑功能成为破坏。症状包括无意识的颤抖的身体,和疾病可以造成巨大的痛苦。开发药物来减缓或停止的疾病,研究人员试图了解背后的分子机制如何α-synuclein导致神经元的变性。
众所周知,线粒体,细胞的能源生产车厢,在帕金森病受损,可能由于α-synuclein“淀粉”。淀粉体块蛋白质的安排与一个秩序井然的核心结构,长纤维及其形成基础许多神经退行性疾病。淀粉或更小的块α-synuclein可能结合,破坏线粒体膜,但确切的机制仍然未知。
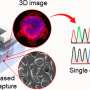
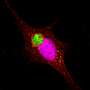
这项新研究最近发表在杂志上PNAS专注于两种类型的膜状般的小泡,胶囊的脂质膜可以作为模仿的细胞中发现的。的一个囊泡是由脂质中经常发现突触囊泡,另一个包含线粒体膜脂质相关。
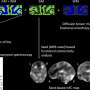
研究人员发现,帕金森的蛋白质将两者结合囊泡类型,但只有mitochondrial-like囊泡结构的变化引起的,畸形的不对称和泄露其内容。
“现在,我们已经开发出一种方法足够敏感,观察α-synuclein囊泡与个体相互作用模型。在我们的研究中,我们观察到α-synuclein绑定和destroys-mitochondrial-like膜,但没有破坏synaptic-like膜的囊泡。损害发生在非常低,摩尔浓度,蛋白质只存在monomers-non-aggregated蛋白质。如此低的蛋白质浓度已经很难研究之前,但我们现在发现的反应可能是疾病过程中关键的一步,”佩妮说Wittung-Stafshede,化学生物学教授生物学和生物工程系。
的新方法可以查尔姆斯理工大学的研究人员研究不使用荧光标记添加极少量的生物分子。当跟踪自然反应这是一个很好的优势,因为标记通常影响到你想观察的反应,特别是在处理小α-synuclein等蛋白质。
“化学使用的两种脂质之间的差异非常小,但我们仍发现显著差异α-synuclein如何影响不同的囊泡,“Pernilla Wittung-Stafshede说。
“我们相信,脂质化学并不是唯一的决定因素,但也有宏观区别这两个membranes-such动力学和脂质之间的相互作用。没有人真正仔细观察发生的膜本身当α-synuclein结合,在这些低浓度,从不。”
研究人员下一步是调查变异α-synuclein蛋白质的突变与帕金森病有关疾病,调查更类似于细胞膜的脂质囊泡。
“我们也想进行定量分析来理解,在机械的层面,个体蛋白质表面聚集膜可以造成损害”弗雷德里克•钩说物理系教授,他也参与了研究。
“我们的愿景是进一步细化的方法,这样我们不仅可以研究个人、小- 100 nanometres-lipid囊泡,还跟踪每一个蛋白质,即使他们只有1 - 2纳米大小。这将帮助我们揭示小的脂质膜的性质的变化如何导致这样一个不同的回应蛋白质结合我们现在观察到。”
更多信息:乔纳斯k Hannestad et al, Single-vesicle成像揭示了lipid-selective和逐步由单体α-synuclein膜破坏,美国国家科学院院刊》上(2020)。DOI: 10.1073 / pnas.1914670117