首先研究药理学伴侣治疗可防止阿尔茨海默氏菌在老鼠中

就像一段带子会弯曲、粘在一起,然后变成一个球一样,开始失去形状的蛋白质会变得粘稠,并倾向于聚集在一起。当这种情况发生时,陈旧或功能失调的蛋白质不是被运送到细胞内的回收点,而是被困在细胞的小室中。最终,它们累积到破坏细胞机制的程度,导致重大问题。
幸运的是,细胞配备了检测缺陷蛋白质的分子机械,将它们分类,然后除去或稳定它们,防止它们积累并造成伤害。近年来,科学家们已经开发出小药物分子,称为药理伴侣,可以帮助在这个过程中。
现在,寺庙大学刘易斯卡茨医学院的科学家表明,药理伴侣可以在阿尔茨海默病治疗中填补关键作用。在一项新的研究中在线发表于1月21日在期刊分子神经退化,他们描述了一种新的药理学伴侣,能够预防容易患上阿尔茨海默病的动物。
这项研究首次表明,一种药理伴侣药物可以有效地扰乱损害大脑神经元、导致记忆丧失并最终导致阿尔茨海默病的异常过程。
“我们的伙伴药物特别恢复了一种被称为VPS35的排序分子的水平,它有助于将蛋白质从核内体中转移出来,核内体是细胞内的小室,在那里蛋白质被分类并降解,”Domenico Praticò医学博士解释说,他是斯科特·理查兹北极星慈善基金会阿尔茨海默病研究主席,刘易斯·卡茨医学院药理学和微生物学系教授,坦普尔老年痴呆症研究中心主任。Praticò博士是这项新研究的高级研究员。
将蛋白质从内体贩运到细胞膜或称为GOLGI设备的另一个细胞室是正常细胞功能的基础。VPS35对该贩运系统特别重要,因为它分离了功能障碍和旧蛋白质,并将它们送去回收。
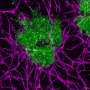
在之前的工作中,Praticò博士和他的同事们发现VPS35能够主动清除大脑中潜在的有害蛋白质,如β淀粉样蛋白和tau蛋白。然而,在阿尔茨海默病中,vs35水平降低。这种减少与神经元内tau蛋白缠结的形成以及神经元外β淀粉样蛋白的积累有关。最终,这些异常蛋白质的沉积会中断神经元活动,导致神经退行性疾病,包括阿尔茨海默氏症。
在新的研究中,研究人员研究了药理伴侣在工程中蛋白质分选的作用,以便在年龄增长时进行阿尔茨海默病。在他们开始表现出疾病症状之前,从年轻时治疗小鼠。随着动物成长的增加,他们被测试了对记忆和学习的影响。
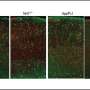
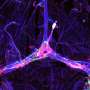
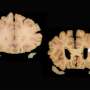
帕特拉特博士的团队发现,与未经治疗的小鼠与用于阿尔茨海默病的未经处理的小鼠相比,治疗的动物具有更好的记忆,表现得像正常或野生型小鼠一样。当研究人员检查治疗小鼠的神经元时,他们观察到Tau缠结的显着降低,以及淀粉样蛋白β斑块的减少 - 另一种类型的蛋白质导致阿尔茨海默病的因素研究人员进一步注意到,在药物伴侣疗法后,vs35水平得到了恢复,神经元聚集在一起交换信息的连接(即突触)功能完全正常。
“相对于阿尔茨海默氏病的其他疗法,药理伴侣价格便宜,其中一些药物已被批准用于治疗其他疾病,”帕特拉特博士说。“另外,这些药物不会阻断酶或受体,而是靶向诱导细胞机制,这意味着副作用的潜力较低。所有这些因素都会增加追求药理伴侣药物作为新的阿尔茨海默治疗的吸引力。”
在搬到试验之前人类患者然而,Praticò博士计划下一步研究药理学的作用伴护对老年小鼠的治疗。“因为我们最近的调查是一项预防性研究,我们现在想知道这种疗法是否也可以用于治疗已经被诊断为老年痴呆症的患者疾病,”他补充道。
进一步探索














用户评论