新的研究发现炎症分子控制毛细血管损失
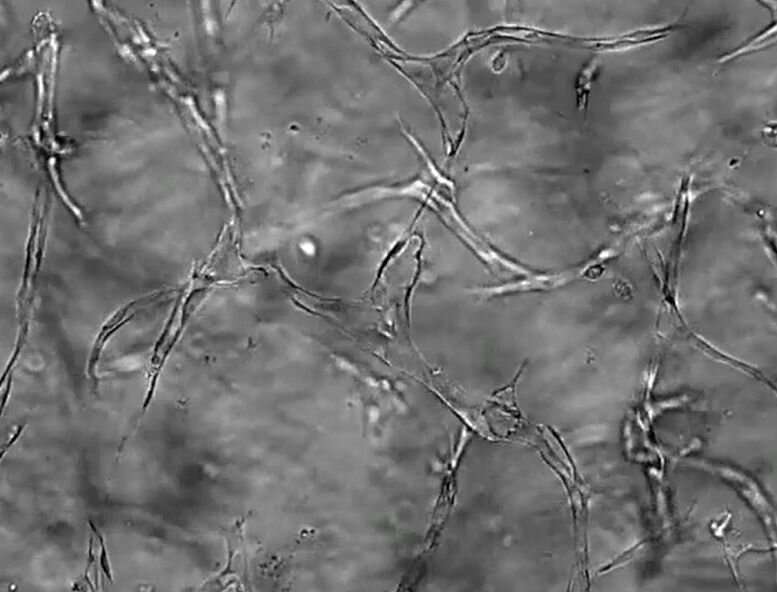
许多疾病都是由于我们的毛细血管异常引起的,这些微小而精巧的分支血管网络在组织健康中起着至关重要的作用。研究人员已经了解了很多关于毛细血管形成和生长的分子通讯,但是对于是什么导致这些正常组织功能的关键调节因子崩溃和消失还知之甚少。
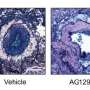
“毛细管回归(损失)是一种被低估了,然而深刻,很多疾病的特征,特别是那些影响器官需要大量氧气正常工作,”乔治·戴维斯说,医学博士,分子药理学和生理学教授南佛罗里达大学健康(普遍服务基金健康)Morsani医学院,佛罗里达州的坦帕。
“如果我们知道怎么做血管被改变或开始分解我们应该能够在药理学上修复它,“USF健康心脏研究所的成员戴维斯博士说。
在12月19日发表在《美国心脏协会杂志》(American Heart Association journal)上的一项研究中,戴维斯博士领导的一个团队进一步了解了毛细血管如何退化动脉硬化,血栓形成和血管生物学。USF健康研究人员与俄克拉荷马州医学研究基金会的Courtney Griffin博士的实验室合作。ob欧宝直播nba
研究人员发现,三个主要的促炎介质 - 中间蛋白-1β(IL-1β),肿瘤坏死因子α(TNFα)和凝血酶单独且特别是当组合时,直接驱动毛细血管回归(损失)在高血压等疾病中发生,糖尿病,心血管疾病,神经变性疾病和恶性癌症。他们还确定了药物中和抗体的组合,以特异性阻断IL-1β和TNFα,或药理学抑制剂的组合 - 显着干扰毛细血管回归。
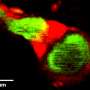
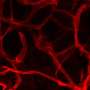
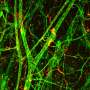
毛细血管,我们的身体最小,最丰富的血管,将动脉与静脉连接,交换氧气,养分和血液中的血液和组织之间的浪费。戴维斯实验室在定义的无血清条件下培养了三维人类“血管网络”,以探测毛细血管如何形成健康组织的复杂性。最近,他的团队已经开始申请他们使用这种创新的体外模型来攻击,并可能保护疾病。
在这项研究中,研究人员培养了两种人类细胞:内皮细胞周细胞被招募来强化内皮管的外表面。这些细胞之间的交叉交流控制着血管网络的形成、分支和稳定。巨噬细胞是一种免疫细胞,在细胞培养基中被激活,模拟一个高度有利于毛细血管退化的组织损伤环境。
主要研究发现如下:
- 巨噬细胞衍生的分子IL-1β和TNFα与凝血酶合并,选择性地引起内皮衬里的毛细管网络以回归;然而,周刊在退化毛细血管周围继续增殖。为什么周刊仍然是一个有趣的问题,但戴维斯博士建议这些更多的弹性细胞可以留下来帮助修复被炎症损坏的组织。
- IL-1β和TNFα结合凝血酶,诱导一组独特的分子信号,导致血管损失。这种“毛细血管回归信号信号”与戴维斯博士和其他人先前确定的表征毛细血管形成和生长的生理途径相反。
- 某些药物组合(研究人员鉴定)可以阻断IL-1β,TNFα和凝血酶促进的毛细血管损失。
USF Health的研究人员发现了其他几种促进毛细血管丢失的促炎分子,但没有一种被证明比IL-1β、TNFα和凝血酶更有效,特别是当三者结合时。
对抗IL-1β和TNFα作用的抗体已经被用于治疗一些炎症性疾病,包括动脉粥样硬化、类风湿关节炎和克罗恩病。医生会给心房颤动、深静脉血栓形成和肺栓塞的病人开直接的凝血酶抑制剂。
“这些药物已经有了,而且很有效。我们的数据表明,如果把它们结合起来,实际上可能会防止血管破裂(在疾病过程的早期),并改善结果,”戴维斯博士说。
USF健康团队计划调查异常的毛细血管反应如何影响特定疾病状态的细胞和组织的丢失,如败血症、缺血性心脏病和中风。戴维斯博士说,他们的三维血管网络模型也可以很容易地用于筛选更多的潜在药物。“我们已经确定了一些有希望的(现有的)药物毛细血管回归 - 但可能有更多的治疗机会。“
进一步探索







用户评论