通过肿瘤抗原鉴定和转化为DNA疫苗的抗癌

Wistar的科学家和合作者展示了一种优化的合成DNA疫苗平台的效用,可快速诱导对独特的肿瘤新抗原组合的免疫。这些结果揭示了一个直接的途径来有效地解决肿瘤的变异性,这对有效的免疫策略的发展提出了巨大的挑战。
这项研究发表在癌症免疫学研究提出了从患者中快速筛选新抗原和设计新抗原的技术疫苗可以在单一配方中简单表达数十种抗原的抗原盒。与其他方法相比,这种个性化方法产生了更高的CD8+ t细胞免疫力。它还提供了一种简单、持续和有效的系统,能够有效地进行杀戮肿瘤细胞,减缓肿瘤的生长以及深深的拖延或阻止瘤肺部临床前模型的进展卵巢癌,根据研究。
在疾病进展过程中,癌症细胞积累大量的基因突变。该过程产生新的抗原,称为新抗原,其不存在于正常细胞中,因此可以是免疫应答的靶标。有效个性化治疗的主要目标癌症患者将迅速识别以患者特异性的基础表达的独特的新宿人员,并使用该信息将匹配的多样化抗原收集到疫苗中,该疫苗可以简单地施用到该患者以产生CD8 +杀伤T细胞。
“新抗原是一个非常有前景的研究领域,”通讯作者David B. Weiner博士说,他是威斯塔研究所的执行副总裁,威斯塔疫苗和免疫治疗中心主任,W.W. Smith癌症研究慈善信托教授。“之前的策略在几个方面受到限制,包括疫苗中编码的新抗原的数量和疫苗产生的速度。大多数之前的疫苗产生的CD8杀伤T细胞比例较低,CD8杀伤T细胞是免疫系统的‘海豹突击队’,能够捕获并消灭病人的特定癌症。”
在这项研究中,Weiner及其同事利用了一种快速的方法来鉴定新的抗原及其在肿瘤中的表达程度,然后使用高级分子工具将数十种已识别的新尼太岛“缝制”成盒,以便以某种方式优化这将导致免疫系统的高呈现。
Weiner补充说:“以前方法的开发速度要慢得多。”“我们已经开发了一种简单的模式,用于快速开发针对从肿瘤中提取的抗原的患者特异性癌症疫苗,并为这种新方法提供了原理证明。”
该团队开始从肺和卵巢癌的三种不同小鼠模型测序肿瘤,并鉴定产生独特的新表位的突变,或在相应的非突变分子中存在改变或不存在的蛋白质的比特。然后,它们设计了DNA质粒,每个表位中的12个串组合,总共七个DNA疫苗和84个新表位。
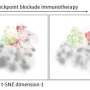
使用受控电池电穿孔在小鼠中递送这些DNA疫苗,以提高它们的效力。与现有方法相反,在本研究中,由疫苗驱动的75%的表位由CD8 + T细胞靶向。这说明平台限制,合成DNA设计和交付的细节都可以影响免疫应答结果。
重要的是,从免疫小鼠中分离并与肿瘤细胞共培养的T细胞只攻击和杀死细胞从它们相应的肿瘤类型,展示其细胞毒性活性的高特异性。研究人员在携带肿瘤小鼠中测试了疫苗,并观察到肿瘤进展的深远延迟,并且疫苗接种后存活率显着增加。
“由于癌症突变的动态特性,这往往是旅客突变,同时针对多个neoantigens对免疫疗法的成功至关重要,因为它可以减少肿瘤逃逸的可能性,“说阿尔弗雷多·佩拉尔斯Puchalt,医学博士,博士,博士后维纳实验室和co-first作者研究。“我们有希望的临床前研究结果保证了这种个性化医疗方法的进一步发展。”











用户评论