2018年8月7日特征
心脏祖细胞接受细胞命运切换以构建冠状动脉
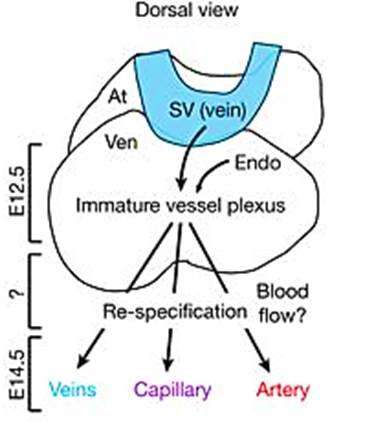
细胞交换命中率并在此期间获取新标识有机组织和再生作为关键特质,尽管这些转换的基础知识的机制很差。脉管系统提供了一种通过区分导弹和静脉来了解这一过程的生物学模型胚胎发生,通过拮抗转录计划。这些计划包括缺口信号以维持动脉和coup-tfs.(也称为NR2F2)以保持静脉。在胚胎发生期间,心脏冠状动脉的一部分源自称为静脉鼻窦威硕(SV)。静脉可以成为开发过程中新动脉的来源,尽管静脉对动脉转化的时序和要求未知。
一群心血管医学和生物工程的科学家最近开发了一种统计学测试,以分类单细胞的细胞亚群RNA测序(ScRNA-SEQ)在小鼠遗传学中的数据集,并鉴定心脏形成期间引起发育过渡的细胞组。现在发表了自然,工作组合统计,计算和生物学分析的SV冠状动脉过渡,显示静脉细胞在细胞子集在前动脉状态越过转录阈值之前逐渐和同时切换到动脉细胞的命运。了解如何在开发过程中禁止抑制信号如何推进组织生长和器官发生的现有知识,提高组织工程战略再生医学。
在研究中,天盐Su等人。首先使用迭代鲁棒主成分分析(RPCA)来鉴定两步统计分析以鉴定和聚类如SV冠状祖细胞(SVC)和SVV),然后进行成对离散测试。结果被仿真确认并呈现在关系图上,以确定发育过渡内皮亚型在亚型APJCREER转基因鼠标线。通过观察连续群体的基因表达变化,在高分辨率中检查细胞命运变化。
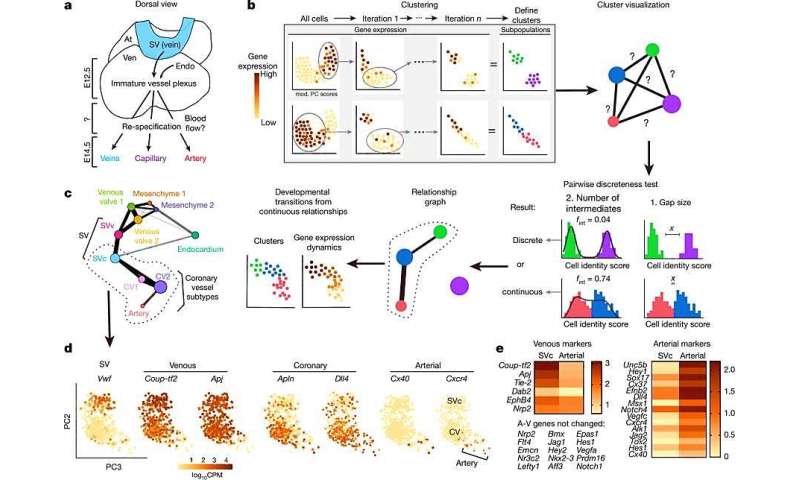
然后,科学家从胚胎第12.5天(E12.5)的小鼠胚胎心中除去谱系标记的内皮细胞以进行额外的分析。统计协会与解剖关系一致。尤其,胚胎细胞在生物血流开始之前向动脉命运表明,那些被称为前动脉细胞。
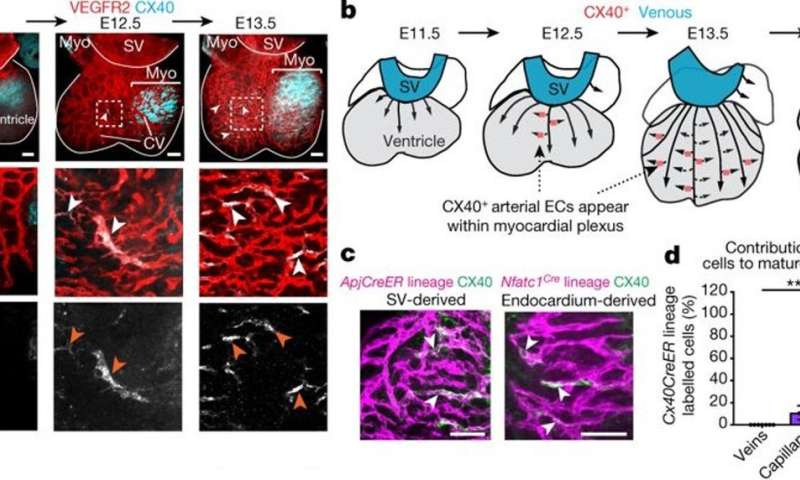
免疫染色的研究也支持预测的胚胎细胞成熟和过渡。对于晚期胚胎阶段的间隙结蛋白连接蛋白(CX40)在E12.5之前出现,表明前动脉细胞作为心脏祖细胞构建大部分成熟冠状动脉的作用。在心脏形成期间血流开始后的额外结构变化被归因于剪切应力。
当静脉到动脉发育转变突出到线性连续体上时,随着细胞朝向前动命运的细胞移动,单静脉细胞的同一性逐渐减少。结果表明,在达到静脉损失的阈值和动脉增益阈值后发生了前动脉规格;起初,静脉标识的丧失是渐进的,然后动脉均衡逐渐增加。
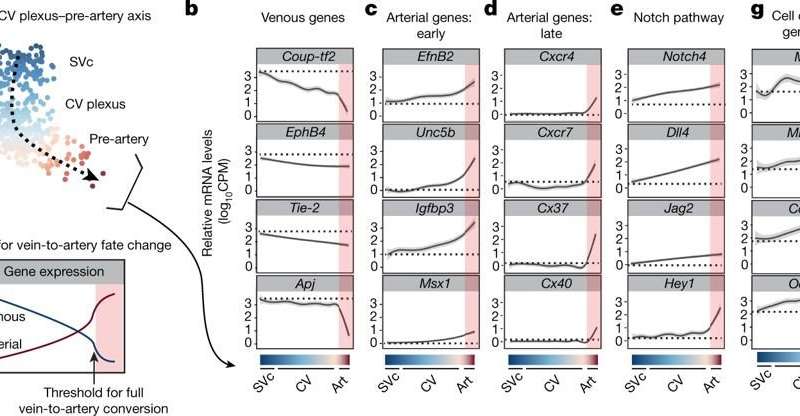
为了确定动脉形成所需的前动脉规格,研究人员通过阻止该过程进行实验室中的功能丧失研究。这是通过COUP-TF2的调节剂,通常诱导静脉命运(同时拮抗动脉命运)。前动脉规格前的Coup-TF2的强迫表达阻断了冠状动脉的细胞动脉- 表明未能获得前动命运。
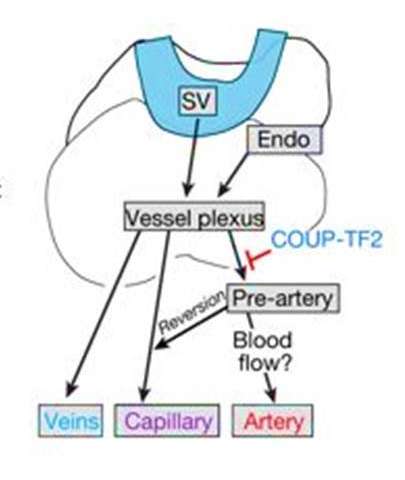
数据显示在期间的命运切换血管生成当个体祖细胞达到阈值时逐渐发生区分进入最终形成成熟冠状动脉的前动脉细胞。基础科学的研究可以通过这种方式提供了解蜂窝机制的洞察力,提供潜在的治疗应用。未来的实验可以在血管生成期间调查心动动脉分化,以帮助开发再生疗法。
进一步探索
内皮细胞是心脏周细胞和血管平滑肌细胞的祖细胞www.ncbi.nlm.nih.gov/pubmed/27516371.陈等,自然通信,2016年8月。
面向对象的鲁棒多变量分析的框架www.jstatsoft.org/article/view/v032i03.Todorov等,统计软件,2009年10月。
冠状动脉发展:祖细胞和分化途径www.ncbi.nlm.nih.gov/pubmed/27959616.Sharma等,生理学年度审查,2017年2月
通过心肌内膜VEGF信号传导通过血管生成形成冠状动脉的内膜细胞www.ncbi.nlm.nih.gov/pubmed/23178125.Wu等,2012年11月,细胞
基因集浓缩分析:一种基于知识的解释基因组表达概况的方法www.ncbi.nlm.nih.gov/pubmed/16199517.Subramanian等,国家科学院的诉讼程序
人血外生物干细胞谱系承诺是一个连续的过程www.ncbi.nlm.nih.gov/pubmed/28319093.velten等,自然细胞生物学,2017年4月
©2018 M欧宝娱乐地址edical Xpress











用户评论