'Crisp-Gold'修复了小鼠的Duchenne肌营养不良突变
加州大学的科学家伯克利设计了一种新的方式来提供细胞内的CRISPR-CAS9基因编辑技术,并在小鼠中证明了该技术可以修复导致杜氏肌营养不良症的突变,严重的肌肉萎缩疾病。一项新的研究表明,单一注射Crispr-Gold,因为新的递送系统被称为Duchenne肌营养不良症的小鼠导致了18倍的校正速率,而且相比,强度和敏捷性测试的两倍增加控制组。
自2012年以来,当学习联合作者Jennifer Doudna,UC Berkeley的分子和细胞生物学教授和Max Planck感染生物学研究所的Conteague Emmanuelle Charpentier,重新培育了Cas9蛋白,以廉价,精确和易于使用的基因编辑,研究人员希望基于CRISPR-CAS9的疗法将有一天彻底改变治疗遗传疾病。然而,遗传疾病的发展治疗仍然是医学中的一大挑战。这是因为只有在疾病的基因突变被纠正回正常序列时,才能固化大多数遗传疾病,并且这与常规治疗剂不可能进行。
然而,CRISPR / CAS9可以通过切割突变的DNA来纠正基因突变并触发同源染色的DNA修复。然而,在可以实现CRAP-CAS9的治疗剂的潜力之前,需要开发安全地递送必要组分(CAS9,指导CAS9给特定基因的指导RNA和供体DNA的指导RNA)的策略。将CRISPR-CAS9递送到细胞中的常用技术使用病毒,但该技术具有许多并发症。Crispr-Gold不需要病毒。
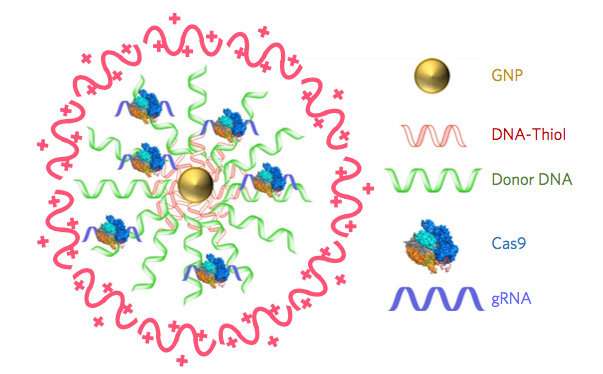
在新的研究中,伯克利生物工程教授的研究领导德伦穆尔蒂维教授和伊琳娜·科博教授认为,他们的新方法称为Crispr-Gold,因为金纳米粒子是关键组成部分,可以提供Cas9 - 结合和切割DNA的蛋白质 - 沿着用指导RNA和供体DNA进入生物体的细胞以修复a基因突变。
“Crispr-Gold是一种输送车辆的第一个例子,可以提供纠正基因突变所需的所有CRISPR组分,而不使用病毒,”Murthy说。
该研究于10月2日出版自然生物医学工程。
Crisp-Gold通过称为同源定向修复的过程修理DNA突变。科学家们努力开发同源性的基于维修的治疗方法,因为它们需要在同一个地方和时间作为Cas9蛋白的活动,该RNA指南识别突变和供体DNA以校正突变。
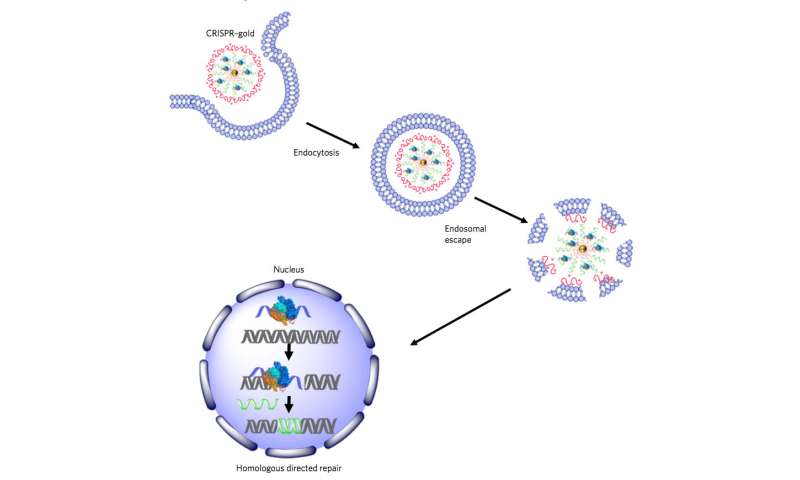
为了克服这些挑战,伯克利科学家发明了一种将所有这些组分结合在一起的递送船,然后当船舶在各种各样的细胞类型内时释放它们,触发同源定向修复。CRISPR-GOLD的金纳米颗粒涂上供体DNA并结合CAS9。注射到小鼠时,它们的细胞识别Crispr-Gold中的标记,然后进口船只。然后,通过一系列细胞机制,CrisPr-Gold被释放到细胞的细胞质中并分开,快速释放的Cas9和供体DNA分裂。
单一注射Crispr-Gold成小鼠的肌肉组织,模型Duchenne肌营养不良症恢复了5.4%的肌营养蛋白基因,这导致疾病,野生型或正常序列。这种校正率大约比用Cas9和供体DNA处理的小鼠高出18倍,其自身仅经历了0.3%的校正速率。
重要的是,研究作者说明,Crispr-Gold忠实地恢复正常营养不良症序列,这是对先前公布的方法进行了重大改进,只会消除基因的故障部分,使其更短,将一种疾病转化为另一个疾病,较为升级的疾病。
Crispr-Gold还能够降低组织纤维化 - 肌肉疾病的标志,肌肉不起作用,而Duchenne肌营养不良症的小鼠的强度和敏捷性。与注射对照的小鼠相比,Crispr-Gold-Propered小鼠在常见的鼠标强度和敏捷性中的持续测试中增加了两倍的悬垂时间。
“这些实验表明,通过简单地开发可以同时包封所有CRISPR组件的纳米颗粒,可以开发可以安全地纠正基因突变的非病毒CRISPR治疗方法,这是可以通过同时染色的纳米颗粒来安全地纠正基因突变。”Murthy说。
该研究发现,Carrpr-Gold对Cas9蛋白递送的方法比CRISPR的病毒递送更安全,除毒性外,还通过该DNA切割酶的连续表达,扩增CAS9的副作用。当研究团队在小鼠中测试了Crispr-Gold的基因编辑能力时,他们发现Crispr-Gold有效地纠正了导致Duchenne肌营养不良症的DNA突变,并具有最小的侧支DNA损伤。
研究人员量化了CrisPr-Gold的偏移DNA损伤,发现损伤水平与典型的DNA测序误差中未暴露于CRISPR的典型细胞(0.005-0.2%)。测试可能的免疫原性,血流细胞因子谱老鼠在Crispr-Gold注入后24小时和两周分析。Crispr-Gold没有引起血浆中炎症细胞因子的急性上调,经过多次注射或减肥,表明Crisp-Gold可以安全地使用多次,并且它具有高治疗窗口,用于肌肉中的基因编辑组织。
“Crispr-Gold和更广泛地,Crispr-Nanoparticles开辟了一种更安全,准确控制的基因编辑工具的新方法,”康博说。“最终,可以将这些技术开发成Duchenne肌营养不良和许多其他遗传疾病的新药。”
需要临床试验,以辨别Crispr-Gold是否是人类遗传疾病的有效治疗方法。研究共同作者Kunwoo Lee和Hyo Min Park已形成一个启动公司,生殖器(Murthy在Genedit拥有所有权股权),它专注于将Crispr-Gold技术转化为人类。Murthy和Conboy的实验室也在研究下一代颗粒,可以将CRISPR分成来自血流的组织,并且优先靶向成体干细胞,这被认为是基因校正的最佳目标,因为茎和祖细胞能够基因编辑,自我更新和分化。
“遗传疾病导致毁灭性的死亡率和发病率,以及治疗它们的新策略得到了很大的需要,”穆尔蒂说。“Crisp-Gold能够通过Cas9蛋白,引导RNA和供体DNA的非病毒递送来纠正体内疾病导致的基因突变,因此有可能发展成治疗遗传疾病的治疗方法。”
进一步探索











用户评论