诱导多能性细胞用于纠正导致肌肉萎缩的基因突变
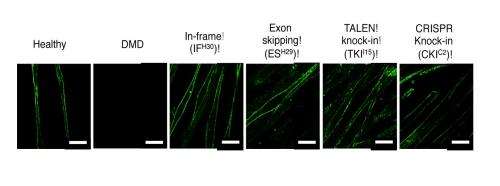
IPS细胞研究和应用(Cira)中心的研究人员,京都大学,表明诱导多能干(IPS)细胞可用于纠正导致杜南肌营养不良症(DMD)的遗传突变。研究,发表在干细胞的报道,证明了工程化核酸酶,例如Talen和Crisp,可用于编辑从DMD患者的皮肤细胞产生的IPS细胞的基因组。然后将细胞分化为骨骼肌,其中负责DMD的突变消失。
DMD是一种严重的肌肉退行性疾病,由肌营养不良蛋白基因中的功能突变引起。它在3500名男孩中造成1人,通常通过成年早期导致死亡。目前,在姑息治疗外的患者的治疗方面非常少。获得兴趣的一种选择是Talen和Crisp的基因组编辑,这迅速成为分子生物学中宝贵的工具。这些酶允许科学家在特定位置切割基因,然后改变残余物以产生基因组序列。然而,可编程核酸酶不是原始的,并且通常错误地编辑类似于目标序列的碱基对的类似序列,使得临床使用的不可靠性,因为不希望的突变可能潜在。
出于这个原因,诱导多能干细胞iPS细胞是理想的模型,因为它们为研究人员提供了大量的病人细胞,在这些细胞上测试可编程的核酸酶,并找到最大限度减少脱靶修饰的最佳条件。CiRA的科学家利用了这一特性,从DMD患者体内生成了iPS细胞。他们使用几种不同的TALEN和CRISPR来修改iPS细胞的基因组,然后分化成iPS细胞骨骼肌细胞。在所有的病例中,抗肌萎缩蛋白的表达都得到了恢复,在一些病例中,抗肌萎缩蛋白基因得到了完全的纠正。
成功的一个关键是开发一个最大限度地减少了离心编辑风险的计算协议。该团队建立了一个数据库,最多可达16个碱基对的序列的所有可能排列。其中,它们提取了那些仅在人类基因组中出现一次的那些,即独特的序列。DMD可能是由几种不同的突变引起的;在本研究中使用的患者的情况下,它是外显子44缺失的结果。因此,研究人员因此构建了独特序列的直方图,该直方图出现在包含这种外显子的基因组区域中。他们在外杉45中发现了一堆独特的序列。根据该项目的Akitsu Hotta,在京都大学持有CiRA和综合细胞材料科学院的联合职位,“近一半的人类基因组由反复序列组成。因此,即使我们找到一个独特的序列,也可以改变一两个碱基对可能导致这些其他重复的序列,这使得TALEN或CRISPR编辑不正确的区域。为了避免这个问题,我们寻求一个在直方图中击中高位的地区“。
通过该目标,该团队认为三种策略来修饰肌营养蛋白基因的帧间移位突变:通过连接外显子43和46来恢复读取框架,通过掺入插入或缺失(indel)突变,以及外显子敲击- 在外显子45之前插入外显子44.所有三种策略都会有效地增加了营养不良骨骼的营养不良蛋白合成细胞,但只有外显子敲击方法将基因恢复到其自然状态。重要的是,编辑显示出非常高的特异性,表明它们的计算方法可用于最小化编程核酸酶的偏离目标编辑。
此外,本文提供了一种原理,用于使用IPS细胞技术处理DMD与TALEN或CRISPR组合。本集团现在旨在将本协议扩展到其他疾病。第一作者丽莎丽解释说:“我们表明Talen和Crispr可以用于纠正DMD基因的突变。我想将核酸酶应用于正确的遗传疾病,如点突变的其他遗传疾病”。














用户评论