研究小组解释了突变的x连锁智力迟钝蛋白是如何损害神经元功能的
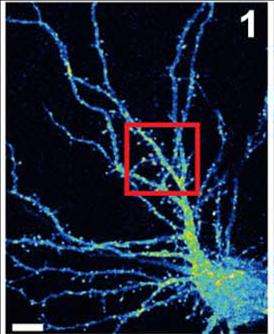
有助于智力残疾和可能其他发育脑疾病的脑细胞发生故障的新线索。
冷泉港实验室(CSHL)的Linda Van Aelst教授一直在仔细研究一种名为OPHN1的正常蛋白是如何帮助大脑兴奋性神经传递的,特别是在含有AMPA受体(AMPARs)的神经细胞对接口。她的团队的新工作,发表于6月24日神经科学杂志,提供新的机制深入了解Ophn1缺陷如何导致突触的神经元突触强度的成熟和调整障碍的损伤,这在脑中普遍存在,并对兴奋性神经递质谷氨酸抑制症。
位于X染色体上的一种名为寡分裂蛋白1 (OPHN1)的基因的突变,此前曾被认为与X染色体相连智力障碍(也被称为X-linked mental retardation)是一种严重影响男孩的疾病,在所有的男性智力残疾中,这种疾病可能占到五分之一。
到目前为止,人们已经发现了几个不同的OPHN1基因突变,所有这些突变都会扰乱神经细胞对OPHN1蛋白的制造。此前,Van Aelst和他的同事证明了OPHN1在突触可塑性(邻近神经细胞调节其连接强度的过程)中起着至关重要的作用。当大脑细胞对刺激流做出反应时,它们会不断调整连接强度。
新发现显示了OPHN1如何涉及贩运AMPARS,神经元具有可塑性的重要特征。神经元将受体移动到远离突触的内部,然后返回到控制连接强度的突触表面。在突触表面,受体在这种情况下为神经递质的对接提供了谷氨酸分子的机会。在细胞烧制之后,表面受体通常被带回内部,在内,它们被回收以供将来使用。
当OPHN1由于基因突变而畸形或缺失时,CSHL团队证明,它不能再正常地发挥受体循环的作用,从而也损害了神经元与邻近神经元保持长期紧密联系的能力,这被称为长期增强。
Van Aelst的新实验解释了与另一种名为Homer1b/c的蛋白质复合物中的OPHN1通常如何与内吞区(EZ)相互作用,以提供一池ampar,并将其带到突触后密度(PSD)位置。当OPHN1发生突变时,神经池不会形成,强化突触所需的受体也没有。长期增强功能受损。
“这表明了一种以前未知的方式,其中OPHN1中的遗传缺陷可以导致谷氨酸系统中的功能障碍,”Van Aelst博士说。“我们早期的研究已经表明,OPHN1在突触在突触的AMPA受体中至关重要。这两个必要的角色在一起表明OPHN1蛋白有多种缺陷性可能导致X链接智力残疾的病理学。”









用户评论