亨廷顿舞蹈症:研究错误折叠蛋白质的毒性操作方法
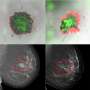
蛋白质是细胞的主力,其正确折叠的三维结构对细胞功能至关重要。错误折叠的结构通常不能正确地完成这些重要的工作,导致细胞压力和毁灭性的神经退行性疾病,如阿尔茨海默氏症、帕金森症和亨廷顿舞蹈症。
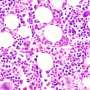
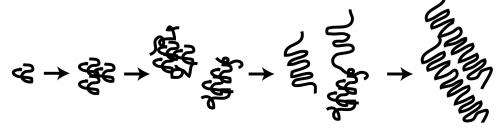
与阿尔茨海默病或帕金森病的奥秘相比,亨廷顿病的罪魁祸首似乎很简单:一种名为“亨廷顿蛋白”(Htt)的聚谷氨酰胺(polyQ)通道的膨胀。这种polyQ膨胀导致Htt蛋白错误折叠,从而引发一系列事件——包括Htt蛋白聚集成非常稳定的、纤维状的、淀粉样的物种,并最终导致神经元细胞死亡。
斯坦福大学弗莱德曼实验室的研究生Koning Shen说:“尽管错误折叠的过程很简单,但我们对为什么httt -一种在所有人体组织中普遍存在的基本蛋白质-在错误折叠时变得如此有毒知之甚少。”
Shen将在2014年2月15日至19日于加州旧金山举行的第58届生物物理学会年会上介绍她的团队为更好地理解蛋白质错误折叠、聚集和细胞毒性之间的关系所做的多方面努力。
亨廷顿舞蹈病中神经元毒性的原因仍然未知。直到最近,人们普遍认为纤维聚集物与亨廷顿舞蹈病的发病机制有关。然而,最新的研究指出,在聚集过程中出现的短暂的中间物种“寡聚物”是神经毒性的关键角色,而不是纤维聚集物。
沈教授解释说:“找出有毒物质不仅有助于解释亨廷顿舞蹈症的发病机制,还可能有助于解释阿尔茨海默病和帕金森病。”
Shen和他的同事们也希望发现哪些分子因素可能有助于或改善Htt毒性。一个扩展的polyQ区域是Htt聚集的分子特征,但两侧的区域也可以改变聚集途径。
“一种名为'TRiC'的分子伴侣可以通过与polyQ-flanking区域之一结合来抑制亨廷顿舞蹈症的发病机制。这些侧翼区域作为探测Htt聚集途径的工具,以了解Htt如何形成有毒聚集物种,以及细胞如何开发工具来阻止它,”Shen说。“改变polyQ通道两侧的区域可能会显著影响亨廷顿蛋白的聚集和毒性。”
这些区域内的缺失或突变可能加剧或减轻聚集-尽管具有相同的polyQ长度。而且,Shen指出,“在这些侧翼突变体中,纤维聚集和毒性并不同时存在。这一发现表明,可能存在通过polyQ区域表现出来的有毒中间物种,这可以由polyQ侧翼区域调节。”
由于这些侧翼区域的调节与polyQ长度无关,使用这些区域进行小分子或多肽治疗的能力对于亨廷顿病患者来说将是强大的,他们已经表达了polyQ扩展的Htt多年。
“通过控制这些侧翼区域,我们可能能够直接影响亨廷顿病患者的聚集途径,”Shen说。“因为TRiC与polyQ侧翼区域的结合抑制了发病机制,所以TRiC和Htt之间的相互作用显示出治疗发展的巨大潜力。”
最近的研究强调了TRiC的一个名为“Apical1”的结构域在抑制Htt发病过程中表现出类似TRiC的作用。“这个小区域可以更容易地适应多肽疗法,并应用于亨廷顿病患者。如果在了解这些错误折叠蛋白质的毒性的基础上进行开发,这种下一代疗法可能会在未来5到10年内出现,”Shen指出。