FDA的问题搁置了备受争议的文迪雅研究
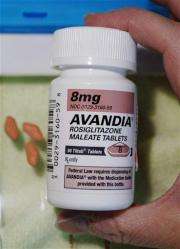
(美联社)——联邦卫生官员禁止新患者参加葛兰素史克公司有争议的糖尿病药物文迪雅的安全研究,一个星期前,一个专家小组裁定该药物会增加心脏病风险。
的食品和药物管理局称其发布了对该研究的“部分临床暂停”,以更新研究人员的最新担忧文迪雅该公司自2007年以来一直受到审查。
上周,一个专家小组投票认为该药物似乎会增加心脏风险,但他们最终投票决定不让该药物上市,因为证据并不确定。
FDA目前正在审查该委员会的意见,并决定采取什么行动。
葛兰素史克公司在一份声明中说,它将停止为所谓的TIDE试验招募人员,并在上周的会议上更新该研究的首席调查员。已经参与这项研究的患者将被允许继续参与。
2007年,在文迪雅的安全问题首次公布后,这家总部位于伦敦的制药商同意进行这项试验。
TIDE研究旨在明确文迪雅的心脏风险是否大于其主要竞争对手艾可图。
上周,FDA的外部顾问小组以20票赞成、10票反对的结果认为,如果文迪雅继续在市场上销售,该试验应该继续进行。
然而,文迪雅的批评者认为,这项试验是不道德的,因为目前的证据已经表明,文迪雅的风险比日本武田制药(Takeda Pharmaceuticals)生产的艾可拓(Actos)更高。
“从道德上讲,这是正确的做法,”该协会主席史蒂文·尼森(Steven Nissen)博士说心血管药物克利夫兰诊所“这是FDA唯一能做出的决定。”
尼森在2007年的一篇估计该药物增加的医学期刊文章中首次引起了对文迪雅风险的注意心脏病风险降低43%。他指出,FDA的顾问小组上周特别投票决定,文迪雅比艾可多增加心脏病发作的风险。
尼森说:“我仍然认为FDA很有可能决定将文迪雅撤出市场。”
TIDE研究计划招募16000名患者,尽管文迪雅的安全问题延缓了招募。葛兰素史克上周报告称,只有1100名患者自愿参加了这项研究。
1999年,FDA首次批准了文迪雅,并迅速成为世界上最畅销的糖尿病药物。然而,由于安全性问题的困扰,该药在美国的销售额从2006年的22亿美元暴跌至去年的5.2亿美元。
这种药物通过增加人体对胰岛素的敏感性来发挥作用,胰岛素是一种用于消化的关键蛋白质,而糖尿病患者不能充分产生这种蛋白质。
FDA在2007年给该药添加了黑框警告。关于该药物安全性的新研究,加上来自安全倡导者的压力,促使该机构重新审视该药物。
FDA预计将在未来几个月决定是否继续在市场上销售该药。
进一步探索
美联社2010。保留所有权利。本材料不得出版、广播、改写或重新分发。









用户评论