研究显示癌症基因如何欺骗免疫细胞
与癌症相关的基因被称为癌基因,众所周知,它能刺激细胞生长和分裂,导致肿瘤膨胀和扩散。但是现在,斯坦福大学医学院和Sarafan ChEM-H的研究人员发现,一种名为Myc的臭名昭著的致癌基因也在免疫系统掩盖癌症生长方面起着直接作用。
Myc与70%以上的人类癌症研究人员认为,揭开这些癌症的面纱可能会导致一种新的癌症治疗方法。
他们发现myc诱导伪装的一个关键成分是糖分子癌细胞表面的涂层。这种糖会向免疫细胞巨噬细胞通常会吞噬并摧毁癌细胞。
这一发现将之前两项看似无关的观察结果联系起来:癌细胞与健康细胞表面的糖模式不同,Myc癌基因通过增加细胞中特定蛋白质的产生,以某种方式保护癌细胞免受免疫系统的侵害。破译两者之间的联系需要两个实验室的合作,一个由糖化学家、最近的诺贝尔奖得主卡罗琳·贝尔托齐博士管理,另一个由癌症专家迪恩·费尔舍博士领导。
“我认为这很可能会导致一种全新的癌症治疗方法,”医学和病理学教授费尔舍说。费尔舍还指导斯坦福大学转化研究和应用医学中心,该中心鼓励医生和基础科学家合作,将他们的研究成果带入临床。“从本质上讲,许多癌症治疗方法都是通过反复试验开发出来的,但这次完全不同。我们知道这一机制,也知道如何针对这一过程。”
“这是一个惊人的联系,”人文科学学院的安妮·t·罗伯特·m·巴斯教授贝尔托齐说。“我的实验室一直试图了解为什么癌细胞会改变其表面的糖的模式,以及这些变化是如何帮助细胞逃脱免疫系统的。现在我们知道Myc调节蛋白质的生产,这些蛋白质制造糖分子,欺骗免疫系统,使其忽略癌细胞。”
Felsher和Bertozzi是Sarafan ChEM-H的Baker家族总监,他们是这项研究的资深作者,该研究于3月10日在《美国科学院院刊》在线发表美国国家科学院学报.研究生本杰明·史密斯和导师安雅·道依兹曼博士是这项研究的主要作者。
基因误入歧途
致癌基因是变坏的好基因。在走向黑暗之前,它们在控制细胞分裂的方式和时间方面起着关键作用。但当它们发生突变或从细胞用来调节其活性的通常严密的调控层中释放出来时,它们就会刺激细胞快速分裂和肿瘤生长。
像许多致癌基因一样,Myc是一种叫做转录因子.转录因子是主要的调节因子,它根据外部和内部信号调节细胞中许多蛋白质的水平。这些蛋白质可以刺激细胞忽略停止分裂的信号,或者避开内置的细胞自杀程序,这些程序旨在清除行为不端的细胞。它们还可以调节细胞的外部环境,诱使不友好的邻居结盟,或促进新血管的生长,为生长中的肿瘤提供急需的氧气。简而言之,一旦出了差错,它们完全准备好了大肆破坏。
费希尔花了几十年时间研究Myc如何引发细胞内外的癌变。在他职业生涯的早期,他开始怀疑Myc也抑制了免疫系统——这在当时是一个相对较新的想法。
Bertozzi是分析每一个活细胞表面的糖或聚糖模式的专家。这些糖的结构极其复杂,它们介导了与其他细胞的关键相互作用,信号分子如激素,病原体如病毒和细菌。他们需要专业的知识和设备来彻底研究,Bertozzi是该领域的世界领导者。
费尔舍和当时费尔舍实验室的博士后学者德伊兹曼已经了解到,Myc可能控制了一种称为糖基转移酶的蛋白质的表达,这种蛋白质是构建蛋白质所必需的复杂的分子包括细胞表面的糖。但他们没有工具或专业知识来追求这一发现。
但在2016年夏天,费尔舍邀请贝尔托齐在他的转化研究和应用医学中心的研讨会上发言。贝尔托齐当时刚到斯坦福大学,他热情地接受了这个邀请。
Bertozzi说:“我来到斯坦福大学是抱着很高的希望,我可以直接与医生互动,了解更多关于人类疾病的知识。”“他们对生物学的了解比我多。所以当迪恩邀请我演讲时,我非常兴奋。我想,“那里会有一群医生!”这对我来说是一件全新的事情。”
在研讨会上,贝尔托齐谈到了她在实验室里观察到的一个她一直在思考的问题。
她说:“我们知道,并且已经知道了一段时间,癌细胞表面的糖分子模式发生了变化,我们想知道是否有机会基于这些变化开发新的治疗方法。”
她说话时,房间里的气氛发生了变化。“讲座结束后,我们的学生聚在一起说,‘这一切都说得通,’”费尔舍回忆道。“我起了鸡皮疙瘩,”贝尔托齐说,从费尔舍和他的实验室成员那里听到Myc和糖基转移酶之间的联系后。“我们意识到这一定是糖的变化方式。”
这两个实验室立即同意合作,Deutzmann和Felsher实验室提供了Myc及其作为致癌基因的作用的信息,Smith和Bertozzi实验室贡献了糖科学的专业知识,也被称为“糖生物学”。
查出Myc的角色
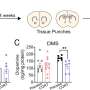
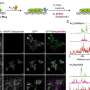
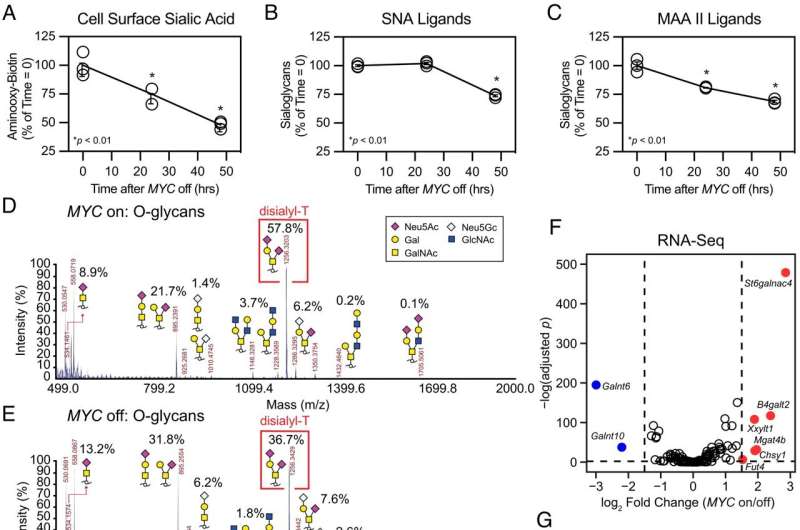
这两个实验室一起发现,Myc驱动一种名为ST6GalNAc4的糖基转移酶的产生,这种酶是制造一种名为二二醛- t的糖分子所必需的,这种糖分子大量出现在Myc驱动的癌细胞表面。Disialyl-T与巨噬细胞表面的另一个分子结合,使它们一举从敌人变成朋友。
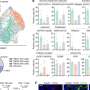
这种互动很重要;由Myc表达驱动但不能制造ST6GalNAc4的白血病细胞,在实验室小鼠中生长更慢,对肿瘤产生的免疫反应比能够制造ST6GalNAc4的细胞更强。此外,Smith和Deutzmann发现,与Myc和ST6GalNAc4水平较低的癌症患者相比,Myc和ST6GalNAc4水平较高的癌症患者预后较差,肿瘤附近的免疫细胞也较少。
Bertozzi说:“Myc和糖生物学之间的这种联系真的很惊人,它就在每个人的面前。”“我们从迪恩之前的工作中了解到,Myc可以调节细胞生长分裂,显然对癌症很重要。但不为人知的是,Myc可以驱动癌细胞表面糖的表达,使其逃避肿瘤细胞的识别免疫系统."
研究人员渴望继续他们的伙伴关系,以开发新的癌症治疗方法。
“从我们的角度来看,接下来有两个明显的研究方向,”Bertozzi说。“首先,我们想测试其他致癌基因是否也会影响癌细胞表面的糖结构。其次,我们想看看我们是否可以抑制ST6GalNAc4来增强巨噬细胞破坏的能力癌症细胞."
“斯坦福正在做的事情——有意地将来自不同领域的医生和基础科学家聚集在一起——正是我们将要治愈疾病的方式,”费尔舍说。
更多信息:Benjamin a . H. Smith等人,myc驱动的Siglec配体合成是一个糖免疫检查点,美国国家科学院院刊(2023)。DOI: 10.1073 / pnas.2215376120