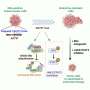
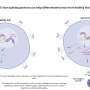
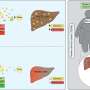
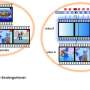
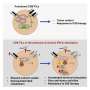
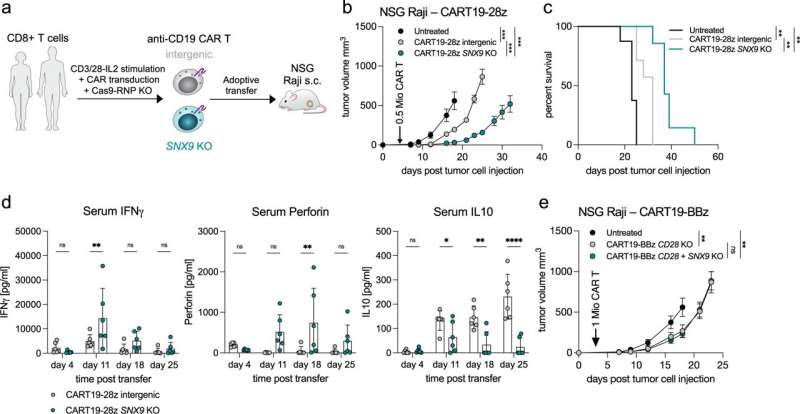
 SNX9的缺失提高了CAR - T细胞的抗肿瘤功效。a CAR - T细胞转移实验示意图。在体外刺激健康供体人CD8 T细胞,用抗人cd19 (FMC63vH)-CD28-CD3zeta-T2A-copGFP CAR构建物慢病毒转导,用Cas9-crRNA-tracrRNA复合体电穿孔,产生SNX9 KO细胞和基因间对照。然后将这些细胞转移到患有皮下Raji肿瘤(CD19+)的NSG小鼠。b肿瘤体积(毫米)3.在Raji肿瘤注射后3天,通过静脉注射0.5 Mio人CD8抗cd19 -28z CAR - T细胞(含或不含SNX9 KO)治疗NSG小鼠(平均和扫描电镜)。统计数据采用两两方差分析,然后进行Bonferroni校正。N = 2个实验中未经处理的N = 8只动物。n = 1个实验中经cart处理的小鼠n = 7只。在CART值较高的情况下进行了相似的重复实验。c 5b组NSG小鼠存活至人道终点1500mm3.肿瘤的大小。统计数据采用对数秩曼特尔-考克斯检验,然后进行Bonferroni校正。(b和c):未经处理的n = 8,基因间和SNX9 KO CAR - T条件n = 7。d用抗cd19 -28z CAR - T细胞加和不加SNX9 KO处理的Raji-bearing NSG小鼠血清中Legendplex (Biolegend)测定的人类细胞因子。统计数据采用双因素方差分析,并进行Holm-Sidak校正。每个条件下N = 6只小鼠。均值和标准差显示出来。e肿瘤体积(单位:mm)3.在Raji肿瘤注射后3天,通过静脉注射1 Mio人CD8+ CD28 KO抗cd19 - bbz CAR - T细胞(含或不含SNX9 KO)治疗NSG小鼠。基因间和SNX9 KO组n = 6,未处理组n = 8。统计数据采用二向方差分析,然后进行Bonferroni校正。* p < 0.05, ** p < 0.01, *** p < 0.001。信贷:自然通讯(2023)。DOI: 10.1038 / s41467 - 022 - 35583 - w
SNX9的缺失提高了CAR - T细胞的抗肿瘤功效。a CAR - T细胞转移实验示意图。在体外刺激健康供体人CD8 T细胞,用抗人cd19 (FMC63vH)-CD28-CD3zeta-T2A-copGFP CAR构建物慢病毒转导,用Cas9-crRNA-tracrRNA复合体电穿孔,产生SNX9 KO细胞和基因间对照。然后将这些细胞转移到患有皮下Raji肿瘤(CD19+)的NSG小鼠。b肿瘤体积(毫米)3.在Raji肿瘤注射后3天,通过静脉注射0.5 Mio人CD8抗cd19 -28z CAR - T细胞(含或不含SNX9 KO)治疗NSG小鼠(平均和扫描电镜)。统计数据采用两两方差分析,然后进行Bonferroni校正。N = 2个实验中未经处理的N = 8只动物。n = 1个实验中经cart处理的小鼠n = 7只。在CART值较高的情况下进行了相似的重复实验。c 5b组NSG小鼠存活至人道终点1500mm3.肿瘤的大小。统计数据采用对数秩曼特尔-考克斯检验,然后进行Bonferroni校正。(b和c):未经处理的n = 8,基因间和SNX9 KO CAR - T条件n = 7。d用抗cd19 -28z CAR - T细胞加和不加SNX9 KO处理的Raji-bearing NSG小鼠血清中Legendplex (Biolegend)测定的人类细胞因子。统计数据采用双因素方差分析,并进行Holm-Sidak校正。每个条件下N = 6只小鼠。均值和标准差显示出来。e肿瘤体积(单位:mm)3.在Raji肿瘤注射后3天,通过静脉注射1 Mio人CD8+ CD28 KO抗cd19 - bbz CAR - T细胞(含或不含SNX9 KO)治疗NSG小鼠。基因间和SNX9 KO组n = 6,未处理组n = 8。统计数据采用二向方差分析,然后进行Bonferroni校正。* p < 0.05, ** p < 0.01, *** p < 0.001。信贷:自然通讯(2023)。DOI: 10.1038 / s41467 - 022 - 35583 - w
艰苦的战斗需要耐力。这同样适用于对付癌症的白细胞,或者更具体地说,适用于T淋巴细胞或T细胞,这是一组参与免疫系统对抗癌细胞的白细胞。然而,T细胞会在这场战斗中耗尽。
巴塞尔大学生物医学系和巴塞尔大学医院的研究人员最近发现了一种可能导致这种疲劳的基因。他们的研究成果发表在杂志上自然通讯.
20年来,T淋巴细胞衰竭一直是一个众所周知的问题。在长期接触肿瘤细胞后,T细胞会进入一种疲惫的状态,变得不那么有效:虽然它们继续识别敌对的肿瘤细胞,但它们产生的清除肿瘤细胞的物质却更少。此外,它们不能再发育成记忆T细胞,而记忆T细胞在支持免疫反应方面很重要。
因此,这种疲惫也会影响免疫疗法的有效性,这些疗法是基于刺激身体自身的免疫防御癌症细胞.该研究的合著者Alfred Zippelius解释说:“这也适用于治疗癌症的细胞疗法:即使将‘新的’T细胞注射到患者体内,疲劳仍然是一个问题。”
微调
因此,研究小组试图更好地了解导致T细胞衰竭的机制。他们开发了一个基于人类肿瘤细胞的模型,并产生了与患者肿瘤中发现的类似的耗尽的淋巴细胞。
研究小组随后检查了各种基因通过使用CRISPR/Cas9方法使它们单独失活。这使他们能够识别一种调节T细胞衰竭的基因。当这种被称为snx9的基因失活时,T细胞仍然保持功能,即使它们在肿瘤附近停留较长时间。
“SNX9基因似乎增加了短期的影响免疫反应在每一小时都很重要的情况下,这一点很重要。然而,在我们的实验中,抑制SNX9基因可以通过减少过度刺激信号来更好地调节免疫细胞的活性。因此,T细胞的活性在较长时间内保持不变,”该研究的主要作者Marcel Trefny解释道。
研究还发现,T细胞不是在完成工作后死亡,而是更频繁地发育成记忆T细胞。Alfred Zippelius说:“这种基因作用的发现为更有效的免疫疗法开辟了新途径。”
这些发现很有希望,因为目前还缺乏防止T细胞衰竭的靶点,而且大多数描述这种靶点的实验都是在小鼠细胞中进行的。然而,这种新方法的治疗应用现在必须进行临床测试,以确定该基因的缺失是否会导致不良反应。
更多信息:Marcel P. Trefny等人,SNX9缺失缓解CD8 T细胞衰竭,有效的细胞癌免疫治疗,自然通讯(2023)。DOI: 10.1038 / s41467 - 022 - 35583 - w
引用:识别驱动T细胞衰竭的基因可能导致更有效的免疫疗法(2023,2月2日)检索于2023年2月6日//www.puressens.com/news/2023-02-identification-gene-cells-exhaustion-effective.html
这份文件受版权保护。除为私人学习或研究目的而进行的公平交易外,未经书面许可,不得转载任何部分。内容仅供参考之用。