科学家揭示了新的tev介导的α pd - l1特异性治疗耐药机制
免疫检查点抑制剂,包括抗pd -1和抗pd - l1抗体(αPD-1和αPD-L1),已经彻底改变了肿瘤免疫治疗。虽然αPD-1和αPD-L1在各种肿瘤类型中表现出优异的疗效,但即使在晚期肿瘤患者中,由于原发性耐药,只有10-30%的患者对αPD-1和αPD-L1治疗有效。
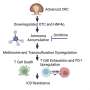
细胞外囊泡(EVs)高度参与肿瘤的进展。PD-L1+肿瘤源性ev (TEVs)引起全身免疫抑制,可能抵抗αPD-L1阻断。然而,PD-L1是否和如何+tev介导α pd - l1治疗耐药性尚不清楚。
近日,浙江大学医学院蔡志坚教授领导的研究团队发表了一篇题为《肿瘤》的文章细胞外囊泡通过诱骗抗pd - l1来介导抗pd - l1治疗的耐药性细胞与分子免疫学“,.这些发现揭示了一种新的tev介导的αPD-L1特异性耐药机制,从而为提高αPD-L1疗效提供了有前景的策略。
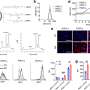
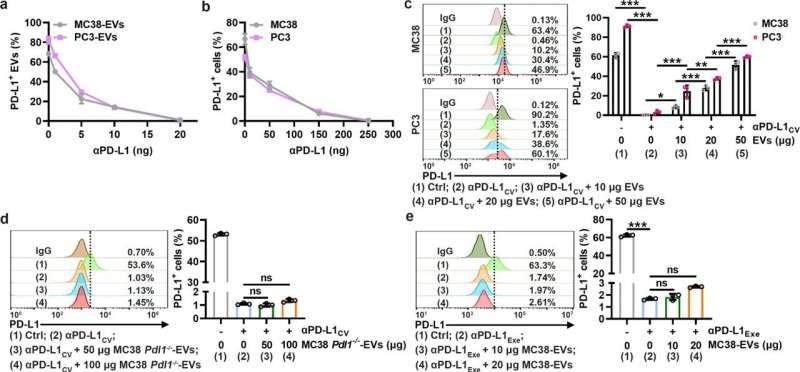
在这项研究中,研究人员发现tev可以与αPD-L1结合并与之竞争肿瘤细胞通过PD-L1进行体外实验。随后,作者将αPD-L1和肿瘤PD-L1的相互作用可视化为一个红色荧光点,通过接近连接试验(PLA)检测到。中国人民解放军肿瘤组织MC38- ev明显降低,但MC38 Pdl1没有明显降低-/-- ev,而通过敲除Rab27a抑制内源性ev的分泌,肿瘤组织中的PLA斑点显著增加。
此外,研究人员还发现,αPD-L1与tev结合后,肝脏和脾脏中的吞噬细胞更多地吸收αPD-L1,从而加速αPD-L1的降解并减少其肿瘤递送量。此外,他们还发现,Pexidartinib (PLX3397)可以消耗巨噬细胞,显著减少外周血单核细胞和肝脏巨噬细胞的数量,消除了携带tramp - c2的小鼠α pd - l1治疗的耐药性。
这些结果表明,靶向巨噬细胞可以有效地阻止tev结合的αPD-L1的清除,从而提高αPD-L1的利用效率和治疗耐药性。
在肿瘤组织中,由于高压环境,很少有抗体能渗透到组织深处肿瘤组织。同时,这些抗体可以被大量tev快速捕获。因此,tev介导的αPD-L1消耗在临床治疗中需要更多的关注。”